Урология №1 / 2016
Причины летальности пациентов разного возраста с раком предстательной железы
Европейский медицинский центр (GEMC), Москва
Введение. Рак предстательной железы (РПЖ) – распространенное заболевание у мужчин и занимает второе место по встречаемости среди злокачественных новообразований (после рака кожи), являясь второй по частоте причиной летального исхода от онкологических заболеваний [1]. В структуре заболеваемости злокачественными новообразованиями мужского населения России на долю РПЖ в 2004 г. приходилось 6,9%, в 2009-м – уже 10,7%. Согласно данным Американской ассоциации рака, в 2014 г. РПЖ выявили у 233 тыс. пациентов, при этом больные РПЖ составили 27% всех больных со злокачественными новообразованиями. В том же, 2014 г. от этого заболевания умерли 29 480 мужчин, что составило 10% от всех случаев летального исхода среди мужчин [2].
За последние годы существенно изменилось понимание этиологии и патогенеза данного заболевания, а также отношение к его лечению. Разработаны эффективные лекарственные средства, увеличивающие продолжительность жизни пациентов с распространенным РПЖ; определились различия в понятиях «гормонрезистентный РПЖ» и «андрогеннезависимый РПЖ»; появились данные, свидетельствующие о гормональной регуляции РПЖ, несмотря на его кастрационную резистентность [3–7]. Несмотря на определенные успехи, некоторые аспекты, касающиеся РПЖ, требуют дальнейшего изучения. К ним относятся поиск маркеров, позволяющих не только выявлять группу людей с высоким риском развития данного заболевания, но и прогнозировать течение заболевания, а также разработка адъювантных методов лечения, направленных на излечение пациентов с местнораспространенной формой РПЖ высокого риска. Крайне актуальной остается проблема отбора пациентов, которым лечение РПЖ жизненно необходимо и принесет больше пользы, чем вреда.
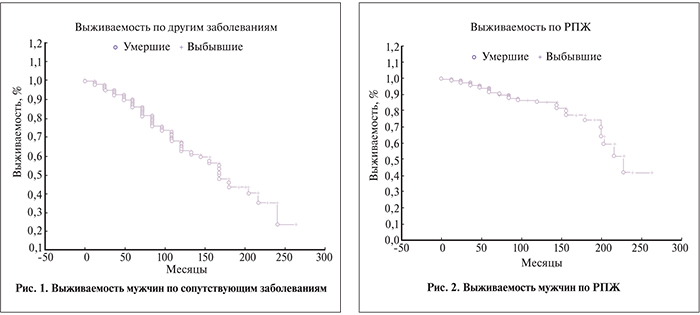
Агрессивность РПЖ зависит от стадии заболевания, степени дифференцировки ткани опухоли и от сроков его обнаружения [8]. По данным аутопсий клинически незначимый РПЖ выявлен у 75% мужчин старше 85 лет, умерших не от РПЖ, а от другой соматической патологии [9]. В работе J. Johansson представлены данные о течении этого заболевания у 223 пациентов с РПЖ, которым не проводилось лечение и скрининг ПСА, в период с 1979 по 2003 г.
Пяти- и 10-летняя раково-специфическая выживаемость составила 94 и 87% соответственно, что позволяет говорить об отсутствии необходимости активного лечения РПЖ у пациентов с ожидаемой продолжительностью жизни менее 10 лет [10, 11]. Однако через 15–20 лет после диагностирования РПЖ наблюдался рост показателя раково-специфической смертности [12, 13]. Спустя 30 лет наблюдения частота местного прогрессирования заболевания составила 41%, отдаленные метастазы выявляли у 18% больных, показатель общей смертности от РПЖ составил 17%. От момента постановки диагноза РПЖ до развития метастазов прошло в среднем 9,2 года, до возникновения летального исхода от РПЖ – 9,5 лет [14].

Важной вехой в диагностике РПЖ стало открытие простатспецифического антигена (ПСА). Уровень этого маркера в сыворотке крови у мужчин в возрасте 50–70 лет является значимым фактором прогрессирования РПЖ [15]. Однако следует отметить, что специфичность данного показателя в отношении диагностики РПЖ довольно низка, поскольку уровень ПСА может повышаться при доброкачественной гиперплазии предстательной железы, ее воспалении или травме, острой задержке мочи, инфекции мочевыводящих путей и других состояниях [8].
В настоящее время нет единого мнения в отношении порогового значения ПСА, специфичного именно для РПЖ. Согласно [16], среди мужчин (средний возраст –72 года) с гистологически подтвержденным РПЖ у 6,6% уровень ПСА был менее 0,5 нг/мл, у 10% – от 0,6 до 1 нг/мл, у 17% – от 1,1 до 2 нг/мл, у 24% – от 2,1 до 3 нг/мл, а у 27% – от 3,1 до 4 нг/мл. Контрольный уровень ПСА 4 нг/мл имеет чувствительность 78,7% и специфичность 59,2% [17]. Повышение порогового значения до 5 нг/мл увеличивает специфичность до 95%, при этом снижая чувствительность до 33% [18]. Важно помнить, что ПСА как скрининговый инструмент не позволяет дифференцировать РПЖ высокого и низкого рисков, а также выявлять его клинически незначимую форму [19].
Американские и европейские исследования по влиянию скрининга на летальность от РПЖ неоднозначны. Согласно данным американского исследования PLCO (Colorectal and Ovarian Cancer Screening Trial), период наблюдения в котором составил 11 лет, проведение скрининга при помощи ПСА не влияет на летальность от РПЖ. В исследовании ERSPC (European Randomized Study of Screening of Prostate Cancer) было показано, что скрининг с использованием ПСА позволяет снижать канцер-специфическую смертность на 20%, а именно уменьшение на 7 см...












