Урология №5 / 2018
Применение комплекса нутриентов при идиопатическом мужском бесплодии в форме астено- и/или тератозооспермии: поиск предикторов эффективности лечения (предварительные результаты)
1 Кафедра урологии и андрологии факультета фундаментальной медицины Московского государственного университета им. М. В. Ломоносова (зав. кафедрой – акад. РАН, проф. А. А. Камалов), Москва, Россия; 2 ФГБУ «Национальный научный центр акушерства, гинекологии и перинатологии им. В. И. Кулакова» Минздрава России (директор –
акад. РАН, проф. Г. Т. Сухих), Москва, Россия; 3 ФБГУ «Поликлиника № 3» Управления делами Президента России
(гл. врач – проф. Е. И. Шарапова), Москва, Россия; 4 ФГБНУ «Федеральный исследовательский центр фундаментальной и трансляционной медицины» (директор – проф. А. М. Шестопалов), Новосибирск; Россия
Актуальность. Мужской фактор диагностируется в половине случаев бесплодного брака [1, 2]. В настоящее время принято считать, что наиболее частой причиной мужского бесплодия (35–40% случаев) являются идиопатические олиго-, астено- и/или тератозооспермии [3–7]. При этом изменения в количественных и качественных показателях спермы наблюдаются в отсутствие анамнестических факторов риска, при нормальных данных медицинского осмотра и отсутствии отклонений в результатах эндокринных исследований.
Для улучшения качества спермы при идиопатическом бесплодии используются различные лекарственные препараты, наиболее часто – антиоксиданты, витамины, микроэлементы, карнитины, биофлавоноиды [3–13]. Несколько рандомизированных клинических исследований показали потенциал антиоксидантных добавок для лечения мужской субфертильности, связанной с оксидативным стрессом (ОС) [14–16]. По результатам мета-анализа [17], антиоксиданты улучшают жизнеспособность, концентрацию и прогрессивную подвижность, связывание с яйцеклеткой, фрагментацию ДНК сперматозоидов, повышают процент беременностей при естественном зачатии и в программах вспомогательных репродуктивных технологий. Однако, характеризуя качество включенных в анализ исследований, авторы обзора отмечают, что уровень доказательности при этом «низкий» и «очень низкий». На недавно прошедшем конгрессе EAU группа английских авторов [13] представили результаты систематического обзора публикаций, найденных в базах данных OVID MEDLINE, Pubmed и Embase, по применению различных пищевых добавок для лечения идиопатического мужского бесплодия. Отмечено, что только 17 из 1745 статей соответствовали критериям включения, т.е. представляли собой результат рандомизированных плацебо-контролируемых исследований. По мнению авторов, несмотря на то что есть данные об улучшении параметров спермы при использовании некоторых нутриентов (кoэнзим Q10, L-карнитин, витамин Е, омега-3, селен) и увеличении при этом частоты наступления беременностей на 3,4–21,2%, отсутствуют доказательства того, что это коррелирует с улучшением реальной рождаемости [13].
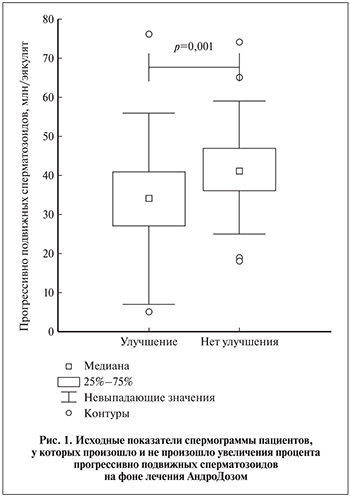 Невысокая стоимость и относительно низкий риск токсичности антиоксидантов привлекательны для пациентов и врачей, поэтому с 2013 г. они рекомендованы EAU для лечения мужского бесплодия, но, как подчеркивается в последнем Руководстве EAU, «не для лечения идиопатических форм» [7]. Причина, очевидно, в том, что идиопатическое бесплодие далеко не всегда является следствием ОС: 30–80% случаев – по обобщенным данным M. Showell et al. [17], около 40% – по нашим данным [18]. В иных случаях применение антиоксидантов представляется малоперспективным.
Невысокая стоимость и относительно низкий риск токсичности антиоксидантов привлекательны для пациентов и врачей, поэтому с 2013 г. они рекомендованы EAU для лечения мужского бесплодия, но, как подчеркивается в последнем Руководстве EAU, «не для лечения идиопатических форм» [7]. Причина, очевидно, в том, что идиопатическое бесплодие далеко не всегда является следствием ОС: 30–80% случаев – по обобщенным данным M. Showell et al. [17], около 40% – по нашим данным [18]. В иных случаях применение антиоксидантов представляется малоперспективным.
Таким образом, показания и ожидаемая эффективность лечения мужского бесплодия антиоксидантами как в режиме монотерапии, так и при комбинированном использовании остаются не вполне ясными.
Цель исследования: установить предикторы эффективности лечения комплексом нутриентов.
Материалы и методы. Проведено открытое многоцентровое проспективное исследование, в которое были включены 102 мужчины из бесплодных пар в возрасте от 25 до 45 лет.
Критерии включения в исследование:
- отсутствие беременности в браке более 12 мес. половой жизни без контрацепции;
- наличие сперматозоидов в эякуляте;
- идиопатическая астенотератозооспермия;
- отсутствие инфекций репродуктивного тракта (Chlamydia trachomatis, Ureaplasma urealyticum, Mycoplasma hominis, Mycoplasma genitalium, Trichomonas vaginalis), диагностированных методом полимеразной цепной реакции;
- отсутствие клинических и лабораторных признаков воспалительного процесса дополнительных половых желез;
- отсутствие выраженных аутоиммунных реакций против сперматозоидов, когда антиспермальные антитела (АСАТ) покрывают не более десятой части подвижных гамет (MAR IgG <10%);
- отсутствие пальпируемого варикоцеле;
- отсутствие выраженной соматической патологии;
- отсутствие психосексуальной и эякуляторной дисфункции.
Все мужчины, включенные в исследование, дали свое информированное согласие.
Обследование мужчин проведено на базе амбулаторных подразделений специализированных клиник уроандрологического и гинекологического профиля, где работают авторы, в соответствии с рекомендациями ВОЗ [1, 2].
Исследование эякулята проведено в соответствии с требованиями ВОЗ (2010): определяли концентрацию, подвижность и долю нормальных форм, вычисляли количество прогрессивно-подвижных сперматозоидов в эякуляте (произведение объема эякулята х концентрацию сперматозоидов х долю прогрессивно подвижных форм). Методом смешанной реакции агглютинации определяли процент подвижных сперматозоидов, покрытых АСАТ (SpermMar Kit, FertiPro, Бельгия).
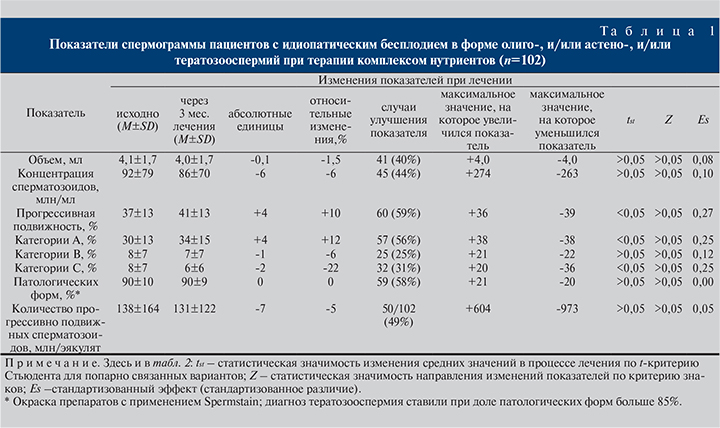
Оксидативный стресс характеризовали, оценивая продукцию активных форм












