Урология №2 / 2022
Применение комплекса природных противомикробных пептидов и цитокинов при мужском бесплодии и хроническим простатите
1) Отделение андрологии и урологии ФГБУ «НМИЦ АГП им. акад. В. И. Кулакова» Минздрава России, Москва, Россия;
2) Российско-финский центр репродуктивной медицины «СканФерт», Москва, Россия;
3) отделение клинической иммунологии ФГБУ «НМИЦ АГП им. акад. В. И. Кулакова» Минздрава России, Москва, Россия;
4) кафедра акушерства, гинекологии, перинатологии и репродуктологии ФГАОУ ВО «Первый МГМУ им. И. М. Сеченова» Минздрава России (Сеченовский Университет), Москва, Россия
Бесплодием в браке страдают около 15% супружеских пар. Около 50% случаев связано с мужским фактором бесплодия. Одной из частых причин мужского бесплодия долгое время считались хронический простатит (ХП) и мочеполовые инфекции.
При этом более чем у 65% пациентов отмечено ухудшение параметров спермы, связанное с клиническими симптомами ХП. Инфекционно-воспалительная интоксикация в первую очередь вызывает изменения биологической активности эякулята — снижение жизнеспособности и подвижности сперматозоидов, а также их морфологической структуры [1-3].
Воспаление остается одним из основных причин мужского бесплодия. Несмотря на то что мужское бесплодие считается серьезной глобальной проблемой, «кусочки» его сложной этиопатологии все еще отсутствуют. Воспалительные реакции в мужской половой системе неразрывно связаны с оксидативным стрессом (ОС). ОС наносит ущерб параметрам мужской фертильности, поскольку вызывает окислительное повреждение репродуктивных клеток и внутриклеточных компонентов. Оба процесса могут быть одновременно обнаружены в патогенезе мужского бесплодия [4, 5].
С одной стороны, активное воспаление (например, при орхите или инфекциях добавочных половых желез) во многом регулируется воспалительными цитокинами, продуцируемыми в том числе клетками Лейдига и Сертоли. Клетки Лейдига и Сертоли располагаются в яичках и связаны между собой щелевыми контактами на границе гемато-тестикулярного барьера. Также цитокины участвуют в регуляции сперматогенеза путем опосредования клеточных взаимодействий и контроля продукции активных форм кислорода (АФК). Помимо этого они влияют на продукцию тестостерона из-за своей активности на разных уровнях гипофизарно-гонадной оси. В связи с этим любое нарушение баланса данных белков может привести к бесплодию [6].
Семейство цитокинов включает более 200 низкомолекулярных белков (от 5 до 20 кДа). После их открытия долгое время считалось, что они продуцируются и секретируются только клетками иммунной системы в ответ на инфицирование патогенными микроорганизмами или серьезные повреждения тканей. Помимо участия в функционировании иммунной системы данные белки влияют практически на все биологические процессы, протекающие в организме, например на эмбриональное развитие, когнитивные функции и дифференцировку стволовых клеток [7].
Период полужизни цитокинов относительно краток. По особенностям строения цитокины разделяются на четыре семейства: семейство гемопоэтинов (ИЛ-2, -4), семейство интерферонов (ИФН-а, -в, -Y), семейства хемокинов и факторов некроза опухоли (TNF). В зависимости от продуцирующих их клеток цитокины разделяют на лимфокины, монокины, хемокины и интерлейкины. И наконец, по способу действия их можно разделить на стимуляторы клеток иммунной системы, провоспалительные цитокины, воспалительные цитокины, противовоспалительные цитокины и цитокины, действующие как факторы роста.
Цитокины характеризуются плейотропностью (один цитокин может по-разному действовать на разные клетки-мишени) и избыточностью действия (различные цитокины могут одинаково воздействовать на одну специфичную клетку) [8].
Помимо этого цитокины по отношению друг к другу могут выступать и как синергисты, и как антагонисты. Кроме этого цитокинам свойственна каскадность действия (они могут индуцировать секрецию клеткой-мишенью других цитокинов).
При этом о роли цитокинов в формировании мужского бесплодия на данный момент известно крайне мало.
Яички выполняют две главные функции: сперматогенез и стероидогенез. Яички относятся к категории иммунно-привилегированных органов. Подобные привилегии необходимы им для защиты от контакта с иммунной системой иммуногенных половых клеток, необходимых для нормального течения сперматогенеза.
Хотя основной субпопуляцией лейкоцитов в яичках являются макрофаги, в них может также определяться значительное число лимфоцитов и тучных клеток. Моноциты-макрофаги могут стимулировать развитие воспаления, продуцируя воспалительные цитокины (например, ИЛ-1 и TNF-а), АФК или хемокины, обладающие лейкотоксическим действием. Однако многие цитокины (например, ИЛ-1, -6, TNF-а и TGF-в) могут также продуцироваться в клетках Сертоли и Лейдига в ответ на действие гонадотропинов [9, 10] (табл. 1) [11].

Сперматогенез представляет собой крайне сложный процесс, для нормального протекания которого необходимо максимально точное взаимодействие между всеми клетками тестикулярного микроокружения. В регуляции данного процесса задействованы паракринные, аутокринные и эндокринные механизмы. По паракринному и аутокринному принципу действуют такие воспалительные цитокины, как ИЛ-1, -2, -6, -10 и TNF-a, продуцируемые КС, лейкоцитами и зародышевыми половыми клетками. Эндокринный же механизм действия наиболее характерен для гонадотропных гормонов, ЛГ и ФСГ. В то же время аутокринный и эндокринный механизмы дополняют и регулируют друг друга, тем самым более точно контролируя процесс сперматогенеза [12].
Тем не менее малейшее нарушение баланса цитокинов даже в такой стабильной среде может приводить к бесплодию.
Однако, так как яички обеспечивают лишь 5% от общего объема эякулята, подобные изменения цитокинового уровня могут быть вызваны их гиперпродукцией в других органах, таких как предстательная железа, семенные пузырьки или придатки яичек. Таким образом, требуется дальнейшее изучения роли цитокинов в формировании мужского бесплодия.
АФК являются естественным побочным продуктом метаболизма кислорода и играют важную роль в поддержании гомеостаза и передаче сигнала между клетками. В частности, их гиперпродукция наравне со многими цитокинами происходит при активации врожденной иммунной системы различными патогенами [13]. Продукция АФК в тканях яичек строго контролируется. АФК принимают участие в оплодотворении [14]. Также АФК как часть врожденной иммунной системы могут приводить к образованию аномальных сперматозоидов.
Присутствие АФК оценивалось как у бесплодных мужчин, так и у мужчин с ненарушенной фертильностью (с/ без инфекций добавочных половых желез). Известно, что воспаление в яичках стимулирует инфильтрацию тканей лейкоцитами, что приводит к повышению уровня АФК. Возникающий при этом оксидативный дисбаланс вызывает перекисное окисление мембран сперматозоидов, тем самым снижая их оплодотворяющий потенциал [15, 16].
Еще 20 лет назад измерение концентрации цитокинов в семенной жидкости не только было технически затруднено, но и считалось не целесообразным. Напротив, гораздо больше внимания уделялось профилактике инфекционных заболеваний, а не их лечению [17, 18]. На сегодняшний же день мнение всего научного и медицинского сообщества о роли воспаления и интерлейкинов в развитии мужского бесплодия значительно изменилось.
В ходе одного из исследований проводился опрос более 400 мужчин с бесплодием. При этом наличие определенных симптомов (боль в промежности или болезненные эякуляции) в сочетании с количеством баллов по NIH-CPS (National Institutes of Health-Chronic Prostatitis Symptom Index)>4 было ассоциировано с повышенным уровнем ИЛ-8 в сыворотке крови. Подобные находки расценивались как признаки воспалительных заболеваний на уровне эпидидимиса, семенных пузырьков или предстательной железы. Результаты данного исследования подтверждают необходимость включения анализа на сывороточный ИЛ-8 в список рутинно проводимых исследований, проводимых при диагностике мужского бесплодия [19].
Крупномасштабные исследования показали, что у пациентов с идиопатическим бесплодием обычно повышен уровень сывороточных ИЛ-2, -4, -6, -8, -21, TNF-a и ИФН-Y [20].
У бесплодных пациентов аналогичное увеличение уровней провоспалительных цитокинов, таких как ИЛ-2, ИЛ-6 и ИЛ-8, обнаруживалось при различных типах патозооспермии, например при олиго-, астено- и тератозооспермии [21].
В другом исследовании были идентифицированы серьезные различия в концентрациях воспалительных цитокинов между группой бесплодных мужчин [варикоцеле, n=22; идиопатическое бесплодие, n=13; рецидивирующий самопроизвольный выкидыш, n=20] и группой фертильных мужчин (n=27). Авторы пришли к выводу, согласно которому рутинные исследования при диагностике бесплодия должны включать определение ИЛ-1, -10, -18 и ИФН-в в сыворотке крови, а также ИЛ-1 и ИФН-в в семенной жидкости [22].
Подобные результаты лишь подтверждают необходимость дальнейшего изучения роли цитокинов в формировании мужского бесплодия [23].
Активация воспалительных цитокинов и хемокинов чаще всего ассоциирована с повышенной продукцией АФК, деятельность которых может приводить к снижению качества спермы мужчин как с лейкоцитоспермией, так и без нее. Более того, хроническое воспаление обусловливают снижение эффективности таких белков антиоксидантных систем организма, как супероксиддисмутаза (СОД), каталаза и пероксиредоксины. Подобное снижение активности врожденных механизмов антиоксидантной защиты повышает восприимчивость сперматозоидов к действию РОС и является отдельным фактором риска инфертильности [24].
Наличие провоспалительных цитокинов в сперме предполагает воспаление в мужских половых железах (например, в предстательной железе), что также ассоциировано со снижением ее качества [25].
Тем не менее в клинической практике метод определения в образцах спермы провоспалительных цитокинов применяется далеко не всегда, что связано с высокой стоимостью и времязатратностью данного исследования [23].
Отечественными учеными проведено комплексное исследование больных ХП и ХП, осложненных бесплодием, по сравнению с условно-здоровыми лицами. Получены данные об изменениях цитокинового профиля плазмы сперматозоидов (повышение уровня ФНО , ИЛ-2, -6, -17) [26].
Те же авторы в 2022 г. оценивали диагностическую значимость цитокинов в плазме спермы мужчин репродуктивного возраста (20—45 лет) двух групп: больных ХП, не осложненным бесплодием, и с потерей фертильности. Отмечено, что основная роль принадлежит цитокину IL-4. Уровень ИЛ-4 сперматозоидов в сочетании с терапевтическим мониторингом может быть использован для медикаментозного ведения больных ХП с целью профилактики развития бесплодия и разработки методов скрининговой диагностики нарушений фертильности у мужчин [27].
В другой работе 2022 г. исследователи задались вопросом: могут ли IFNy, IL-17A, IL-1e и -8 изменять подвижность и жизнеспособность сперматозоидов человека? Фракции жизнеспособных и подвижных сперматозоидов от нормоспермальных здоровых доноров инкубировали in vitro с рекомбинантными человеческими IFNy, IL-17A, -1в или -8 и анализировали продукцию АФК, подвижность, жизнеспособность и апоптоз сперматозоидов. результаты показывают, что IFNy, IL-17A и -1в сами по себе ухудшают подвижность сперматозоидов и снижают жизнеспособность, вызывая повышенную продукцию митохондриальных АФК и индуцируя апоптоз сперматозоидов. Результаты показывают, что скрининг воспалительных цитокинов в сперме будет дополнительным полезным инструментом для диагностики мужского бесплодия [28].
В новом рандомизированном клиническом исследовании 2022 г. 20 партнеров-мужчин пар с репродуктивными потерями у супруги были исследованы на параметры спермы и профиль экспрессии некоторых генов воспалительных и противовоспалительных цитокинов до и после лечения витамином С. У каждого пациента до и после лечения витамином С наблюдалось статистически значимое повышение нормальной морфологии и концентрации сперматозоидов (p<0,05). Уровни ИЛ-6 и ФНО-а были значительно снижены в сперме пациентов после лечения витамином С по сравнению исходным. Напротив, уровни ИЛ-4 и ТФР-в показали значительное увеличение в сперме пациентов после лечения витамином С [29].
В стандартной терапии ХП чаще всего применяются антибактериальные препараты, которые с различной эффективностью устраняют бактериоспермию и лейкоспермию. Но как и сам воспалительный процесс, так и антибиотикотерапия могут влиять на сперматогенез и другие параметры спермы. В литературе встречаются различные исследования, которые демонстрируют негативное влияние антибиотиков как на сперматогенез, так и на фертильность мужчин в целом [1].
Таким образом, полученные результаты продемонстрировали, что антибиотики могут оказывать токсическое воздействие на мужскую репродуктивную систем. Несмотря на негативное влияние в той или иной степени антибактериальной терапии на показатели спермограммы, других подходов к терапии воспалительного процесса урогенитального тракта долгое время не было [30].
С появлением доказательной базы по использованию антиоксидатной стимулирующей терапии стало уделяться внимание этому виду лечения ОС сперматозоидов, особенно в случаях идиопатического бесплодия [31—33].
Эффективными оказались комплексные препараты, содержащие различные антиоксиданты, такие как триовит (витамин Е и селен), трентал (пентоксифиллин), мексидол.
Витамин Е обладает антиоксидантным действием, защищает мембраны сперматозоидов от воздействия свободных радикалов, улучшает жизнеспособность и подвижность сперматозоидов [32].
Селен — важный элемент антиоксидантной системы, встречающийся также в эякуляте: он улучшает подвижность, жизнеспособность и морфологию сперматозоидов [31]. Их в основном изучали в сочетании с другими витаминами, особенно с витамином Е, так как хорошо известно, что он работает в синергии с селеном как антиоксидант [34].
В рандомизированном контролируемом исследовании Keskes-Ammar и др. комбинация витамина Е и Se имела положительное влияние на подвижность сперматозоидов и показатели ПОЛ [35]. Было установлено, что селен оказывает благоприятное влияние на жизнеспособность сперматозоидов, обеспечивая защиту от АФК [36].
Keskes-Ammar et al. рандомизировали 54 бесплодных мужчин на две группы; одни принимали 400 мг витамина Е, 225 мкг селена, другие получали 4—5 г витамина B в день в течение 3 мес. Авторы сообщили о значительном улучшении подвижности и жизнеспособности сперматозоидов в группе витамина Е и селена по сравнению с другой группой [35]. Исследования показали положительные результаты в виде увеличения жизнеспособности сперматозоидов, подвижности и снижения АФК. Лечение также улучшало количество сперматозоидов в сочетании с пентоксифиллином [37].
Мексидол (этилметилгидроксипиридина сукцинат ) был выбран нами как антиоксидантное средство, зарекомендовавшее себя при шоке и гипоксии различного генеза [38].
Обобщая все вышесказанное, можно заключить: высокая активность воспалительных биомаркеров при ХП, а также антиоксидантная терапия влияют на мужскую фертильность и играют важную роль в выживаемости и функционировании сперматозоидов.
Тем не менее исследование методов оценки ОС и экспрессии цитокинов при мужском бесплодии и ХП (особенно при бессимптомном течении, часто встречающемся у пациентов с идиопатическим бесплодием) не используется рутинно в клинической практике.
Целью нашей работы стало изучение влияния комплекса природных противомикробных пептидов и цитокинов (Суперлимф) на показатели спермограммы, МАР-теста, оксидативного стресса (ОС), а также фрагментации ДНК сперматозоидов (ФДНКС) у мужчин с бесплодием и ХП в стадии ремиссии. У части пациентов мы определяли уровень цитокинов до и после лечения.
Материалы и методы. Скринированы 583 мужчины в возрасте 18—75 лет с различными нарушениями эякулята на предмет соответствия критериям включения/исключения в анализ.
Критерии включения: отсутствие беременности у супруги более 12 мес. регулярной половой жизни без контрацепции, наличие ХП в стадии ремиссии, нормальное физическое развитие по данным физикального обследования.
Критерии исключения: установленные генетические причины бесплодия (синдром Клайнфельтера, микроделеции AZF, CFTR), криптозооспермия, азооспермия, некрозооспермия, гипергонадотропный и гипогонадотропный гипогонадизм, выряженная соматическая патология, психосексуальная и эякуляторная дисфункции [39].
Все больные были обследованы с помощью анализа жалоб, данных истории заболевания, анамнеза половой активности, физикального обследования, исследования спермограммы, МАР-теста, определения уровня ОС сперматозоидов (АФК), а также ФДНКС, исследования гормонов крови и выполнения УЗИ органов мошонки с допплерографией, ТРУЗИ простаты.
Больные были разделены на две группы методом адаптивной динамической рандомизации со стратификацией. Группы были сопоставимыми по исходным клиническим и лабораторным показателям.
В связи с тем что пациенты обратились с проблемой бесплодия в браке, обусловленного мужским фактором, основной задачей лечения стало улучшение показателей сперматогенеза и достижение беременности. Поскольку объединяющим для всех пациентов было наличие мужского бесплодия, ассоциированного с ОС сперматозоидов, в качестве основной терапии была выбрана антиоксидантная стимуляция сперматогенеза (АСС) наиболее доступными антиоксидантами (триовит, трентал, мексидол), компоненты которых (витамин Е, селен, пентоксифиллин и др.) показали свою достоверную эффективность, как мы указали во введении.
Несмотря на то что в анамнезе все пациенты имели различные формы ХП, на момент обследования и лечения последний находился в стадии стойкой ремиссии и не требовалось специфического антибактериального и/или противовоспалительного лечения. Таким образом, целью планируемой терапии не являлось лечение ХП в связи с отсутствием каких-либо жалоб, проявлений его обострения или активной фазы.
Пациенты группы I получали антиоксидантную стимуляцию сперматогенеза (ACC) (триовит, трентал, мексидол) в сочетании с комплексом природных противомикробных пептидов и цитокинов (Суперлимф) по 1 свече в прямую кишку (per rectum) 25 ЕД на ночь 20 дней на 1—3 нед. и на 6—8 нед. лечения в течение 2 мес.
Основанием использования такой терапии служили иммунобиологические свойства комплекса природных противомикробных пептидов и цитокинов (Суперлимф), поскольку препарат является иммуномодулятором и обладает противовирусным и противомикробным действиями. Согласно инструкции, препарат стимулирует функциональную активность клеток фагоцитарного ряда (моноцитов и нейтрофилов): активирует фагоцитоз, выработку цитокинов (ИЛ-1, ФНО), индуцирует противоопухолевую цитотоксичность макрофагов, способствует гибели внутриклеточных паразитов, регулирует миграцию клеток в очаг воспаления, увеличивает активность естественных киллеров. Инструкция на препарат Суперлимф представляет данные о том, что он обладает антиоксидантной активностью, снижает развитие воспалительных реакций, стимулирует регенерацию, что является важным механизмом воздействия на патогенез любого воспалительного процесса, включая ХП. Основываясь на большом положительном опыте гинекологов по применению препарата Суперлимф в терапии воспалительных заболеваний органов малого таза у женщин, мы предположили возможность его положительного влияния при подобных заболеваниях и у мужчин. С целью проверки указанного предположения мы предложили пациентам участие в данном проспективном исследовании после подписания информированного согласия. Срок терапии определялся, исходя из инструкции препарата и возможности повторных курсов, и с учетом длительного цикла развития сперматозоидов (60-75 сут.).
Группе II была назначена АСС вместе со свечами для профилактики ХП в течение 2 мес. (рис. 1).
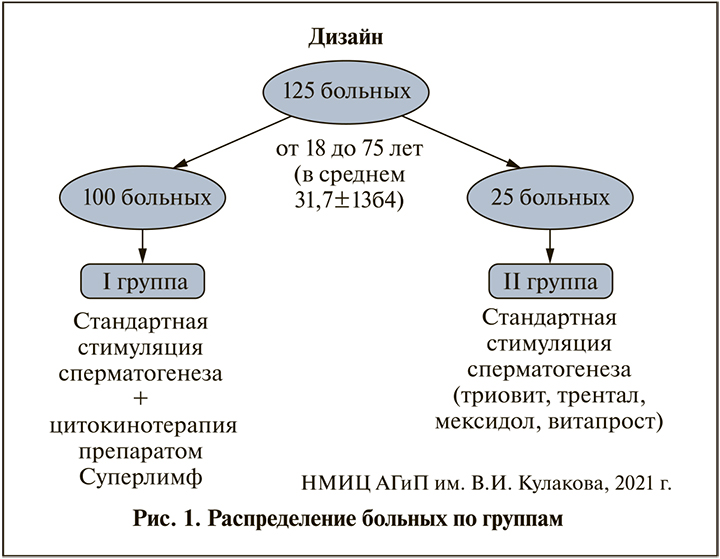
Клиническое наблюдение заключалось в регистрации демографических и клинических данных пациентов до и после окончания 2 мес. указанного курса терапии.
Лабораторное наблюдение заключалось в получении образцов спермы пациентов, участвовавших в клиническом наблюдении, до начала курса терапии и после 2 мес. указанного курса терапии и изучении их по показателям спермограммы (оценивались концентрация, подвижность, морфология сперматозоидов по строгим критериям Крюгера в соответствии с требованиями ВОЗ, 2010), ОС сперматозоидов и ФДНКС.
Также измерялись уровни цитокинов семенной плазмы до и после лечения 32 пациентов с помощью панели Bio-Plex Pro для одновременного определения 17 цитокинов человека, Human Cytokine 17-plex Assay.
Критерием оценки эффективности были показатели спермограммы, МАР-теста, ОС сперматозоидов, ФДНКС через 2 мес. терапии.
Статистическая обработка результатов проводилась при помощи пакета программ «Statistica for Windows, 10.0». данные количественного типа представлены в виде медианы и интерквартильного разброса, качественные - в виде абсолютной и относительной частоты. Для оценки различия средних в попарно несвязанных выборках использовали U-критерий Манна-Уитни, в связанных — критерий Вилкоксона (показатели каждой группы до и после лечения). Достоверность различий качественных признаков проверяли при помощи критерия Хи-квадрат. Разницу считали значимой при p<0,05 [40].
Результаты. Из скринированых 583 мужчин с бесплодием при наличии ХП в анаменезе соответствовали критериям включения/исключения в анализ 135. Собраны результаты до и после лечения у 125 пациентов. Средний возраст больных составил 31,7±13,4 года. Достоверных различий среди пациентов обеих групп по возрасту, длительности бесплодия, формам и срокам перенесенного ХП, гормональным показателям, объему яичек, данным исходных лабораторных исследовании не было.
Отмечено, что наиболее значимые изменения наблюдались в следующих лабораторных критериях.
Средние показатели прогрессивной подвижности сперматозоидов в I группе, пациенты которой получали АСС в сочетании с применением комплекса природных противомикробных пептидов и цитокинов (Суперлимф), возросли с 22,7 до 32,3%. При этом увеличение составило 42,3%, что являлось статистически достоверным.
Во II группе на фоне АСС средняя прогрессивная подвижность сперматозоидов также достоверно возросла с 23,4 до 30,5%. Прирост составил 30,4% (рис. 2).
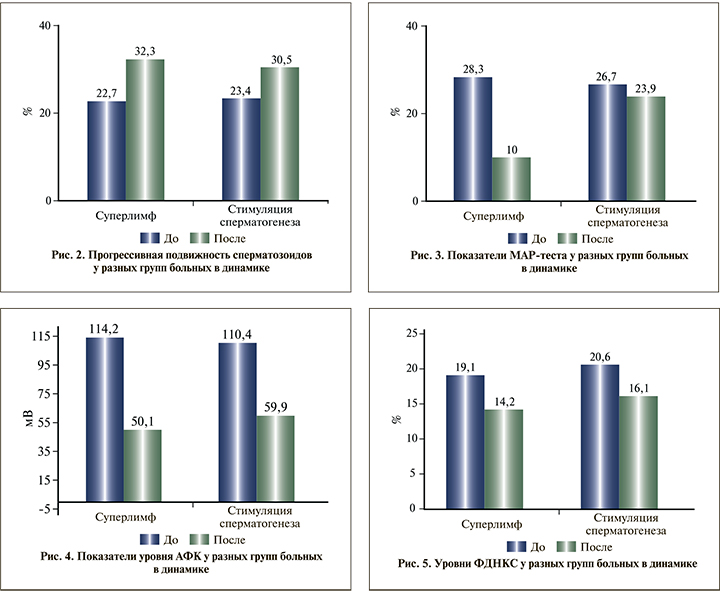
При сопоставлении результатов увеличения прогрессивной подвижности сперматозоидов оказалось, что в группе I добавление к АСС комплекса природных противомикробных пептидов и цитокинов (Суперлимф) привело к более выраженным результатам и эта разница была статистически достоверной.
Средние показатели МАР-теста в I группе, пациенты которой получали АСС в сочетании с применением комплекса природных противомикробных пептидов и цитокинов (Суперлимф), снизились с 28,3 до 10%. При этом снижение составило 64,7%, что являлось статистически достоверным.
Во II группе, на фоне АСС средние показатели МАР-теста снизились с 26,7 до 23,9%, что не являлось статистически достоверным результатом. Снижение составило всего лишь 10,5% (рис. 3).
По уровню ОС сперматозоидов, который определялся с помощью измерения количества АФК, оказалось, что в обеих группах пациентов с мужским бесплодием при наличии ХП в анамнезе он крайне повышен. Таким образом, это подтверждает правильность введения новой нозологической единицы «мужское бесплодие при ОС сперматозоидов» [41, 42].
Исходный средний уровень АФК в I и II группах оказался очень высоким и составил 114,2 и 110,4 мВ соответственно.
После применения АСС в сочетании с комплексом природных противомикробных пептидов и цитокинов (Суперлимф) уровень АФК в I группе снизился до 50,1 мВ. Снижение составило 56,1%, что являлось статистически достоверным.
Во II группе на фоне АСС средний уровень АФК также достоверно снизился - до 59,9 мВ, на 45,7% (рис. 4). Несмотря на это, говорить о полной ликвидации ОС сперматозоидов и снижении АФК до нормы, по нашим данным, не приходится. Возможно, в какой-то мере это могло быть связано с проведением нами наблюдения в эпоху пандемии COVID-19 (2020-2022). Однако такой связи может и не быть.
При сопоставлении результатов лечения мужского бесплодия при ОС сперматозоидов оказалось, что АСС была эффективным видом лечения, но добавление комплекса природных противомикробных пептидов и цитокинов (Суперлимф) привело к более выраженным результатам и эта разница была статистически достоверной.
Весьма интересные данные получены при измерении уровня ФДНКС. Исходно она была повышена и составила в I и II группах 19,1 и 20,6% соответственно.
На фоне АСС в сочетании с комплексом природных противомикробных пептидов и цитокинов (Суперлимф) уровень ФДНКС снизился до нормы 14,2% (менее 15%). Сокращение составило 25,6%, но не оказалось статистически достоверным.
Во II группе АСС нормализации уровня ФДНКС не произошло и средний показатель составил 16,1%. При этом общее снижение было 21,9%, что практически не отличалось от результатов I группы (рис. 5).
Данный факт может говорить о том, что еще недостаточно данных о влиянии АСС в сочетании и без комплекса природных противомикробных пептидов и цитокинов (Суперлимф) на уровень ФДНКС, требуются дальнейшие исследования в этой области.
Другие основные показатели спермограммы, такие как объем, рН и вязкость спермы, концентрация и общее количество сперматозоидов, их морфлогия на фоне лечения в обеих группах, достоверно не менялись. Возможно, это связано с недостаточным для полного цикла созревания сроком терапии или с какими-либо другими причинами, что требует дальнейшего научного изучения.
Дополнительно в группе I у 23 пациентов была произведена оценка уровня цитокинов (20 пациентов до и после лечения, 3 пациента однократно), в группе II - у 25 пациентов (12 и 13 пациентов соответственно).
Оказалось, что исходный уровень интерлейкинов практически не различался в обеих группах (p>0,05), за исключением ИЛ-1в, -17 и TNF-a (табл. 2). Показатели этих цитокинов не учитывались при дальнейшем сравнительном анализе итоговых изменений в группах.

В группе I отмечалось преимущественное увеличение активности противовоспалительных цитокинов (ИЛ-4, -10, -13) и провоспалительного ИЛ-17, снижение уровня провоспалительных цитокинов ((ИЛ-2, -12), уменьшался уровень ИЛ-5, -7. При этом показатели гранулоцитарного колоний-стимулирующего фактора (G-CSF) достоверно увеличивались, а гранулоцитарно-макрофагального (GM-CSF), напротив, достоверно снижались (табл. 3).

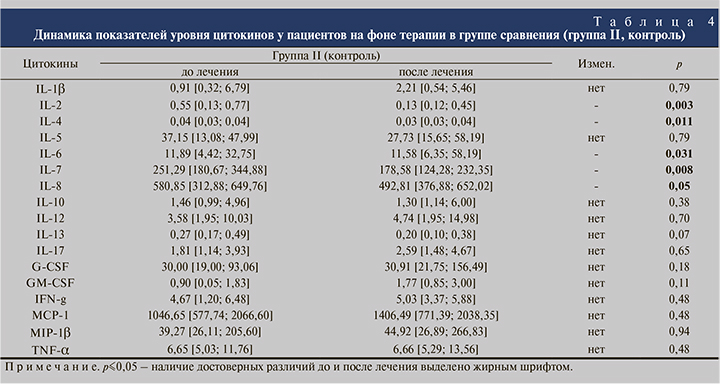
В группе II отмечено достоверное снижение как провоспалительных (ИЛ-2, -6, -8), так и противовоспалительных цитокинов (ИЛ-4), а также ИЛ-7. Остальные изменения были статистически недостоверными (табл. 4).
Среди побочных эффектов легкой степени встречались изменение окраса склер у 4 (3,2%), боли в анальном канале у 3 (2,4%), снижение либидо у 2 (1,6%) пациентов. Различий между группами в частоте встречаемости побочных эффектов зафиксировано не было (p>0,05).
Таким образом, добавление к АСС комплекса природных противомикробных пептидов и цитокинов (Суперлимф) — эффективный и безопасный метод лечения мужского бесплодия при ОС и ХП в анамнезе.
Она приводит к более выраженному:
- увеличению подвижности сперматозоидов (на 42,3%),
- снижению МАР-теста (на 64,7%),
- уменьшению оксидативного стресса сперматозоидов (АФК на 56,1%).
Следовательно, с учетом данных фактов пациентам с мужским бесплодием при ОС сперматозоидов и ХП в анамнезе, желающим максимально значимо улучшить свою фертильность, в комплексной терапии рекомендовано использование АСС, природных противомикробных пептидов и цитокинов (свечи Суперлимф). По нашим наблюдениям, эта комбинация позволяет более эффективно уменьшать ОС сперматозоидов, способствует преимущественному увеличению активности противовоспалительных цитокинов (ИЛ-4, -10, -13), снижению уровня провоспалительных цитокинов ((ИЛ-2, -12), что может иметь место в патогенезе мужского бесплодия при ОС на фоне перенесенного ХП.
Заключение. ACC для пациентов с мужским бесплодием и ХП вне обострения является эффективным и безопасным методом лечения. Добавление к АСС комплекса природных противомикробных пептидов и цитокинов (Суперлимф) приводит к более выраженному увеличению подвижности сперматозоидов, снижению МАР-теста, ОС сперматозоидов, что потенцирует эффекты терапии. Применение препарата Суперлимф сопровождается более выраженным положительным влиянием на факторы патозооспермии, увеличение противовоспалительных и на снижение провоспалительных цитокинов. В отличие от группы контроля, проходившей АСС, где наблюдалось только снижение уровня основных цитокинов. Влияние комплекса природных противомикробных пептидов и цитокинов (Суперлимф) на уровень ФДНКС, а также связь с показателями фертильности, частотой рождения детей требуют дальнейшего изучения.
Список литературы
1. Попова А.Ю., Гамидов С.И., Овчинников Р.И. Использование антиоксидантов в комбинированной терапии мужского бесплодия при воспалительных заболеваниях. Эффективная фармакотерапия. Урология и Нефрология. 2015;4(35):34-38.
2. Olayemi F.O. A review on some causes of male infertility. Afr J Biotechnol. 2010;9:2834-3842.
3. Sinclair S. Male infertility: nutritional and environmental considerations. Altern Med Rev. 2000;5:28-383.
4. Syriou V., Papanikolaou D., Kozyraki A., Goulis D.G. Cytokines and male infertility. Eur Cytokine Netw. 2018;29(3):73-82. Doi: 10.1684/ ecn.2018.0412.
5. Dutta S., Sengupta P, Slama P. et al. Oxidative Stress, Testicular Inflammatory Pathways, and Male Reproduction. J Mol Sci 2021;22(18):10043. Doi: 10.3390/ijms221810043.
6. La Vignera S, Condorelli RA, Vicari E, Tumino D, Morgia G, Favilla V, Cimino S & Calogero AE. Markers of semen inflammation: supplementary semen analysis? J Reprod Immunol. 2013:100: 2-10. Doi:10.1016/j. jri.2013.05.001.
7. Dinarello C.A. Historical insights into cytokines. Eur J Immunol 2007; 37(1):34-45.
8. Zhang J-M., An J. Cytokines, inflammation and pain. Int Anesthesiol Clin 2007;45(2):27-37.
9. Hedger M.P. Testicular leukocytes: what are they doing? Rev Reprod 1997; 2: 38-47.
10. Maegawa M., Kamada M., Irahara M., et al. A repertoire of cytokines in human seminal plasma. J Reprod Immunol. 2002; 54(1-2):33-42.
11. Cheng C.Y., Mruk D.D. The blood-testis barrier and its implications for male contraception. Pharmacol Rev 2012; 64(1):16-64.
12. Kate L., Loveland., Britta Klein, Dana Pueschl et al. Cytokines in Male Fertility and Reproductive Pathologies: Immunoregulation and Beyond. Front Endocrinol (Lausanne). 2017 Nov 20;8:307. Doi: 10.3389/ fendo.2017.00307. eCollection 2017.
13. Kohchi C., Inagawa H., Nishizawa T., Soma GI. ROS and innate immu¬nity. Anticancer Res 2009;29(3):817-22.
14. Goldman R., Ferber E., Zort U. Reactive oxygen species are involved in the activation of cellular phospholipase A2. FEBS Lett 1992;309(2):190-192.
15. Fraczek M., Kurpisz M. Inflammatory mediators exert toxic effects of oxidative stress on human spermatozoa. J Androl 2006;28(2):325-333.
16. Depuydt E., Comhaire H. The relation between reactive oxygen species and cytokines in andrological patients with or without male accessory gland infection. J Androl 1996;17(6):699-707.
17. Hedger M.P. Toll-like receptors and signalling in spermatogenesis and testicular responses to inflammation - a perspective. J Reprod Immunol 2011;88(2):130-41.
18. Dousset B., Hussenet F., Daudin M., Bujan L., Foliguet B., Nabet P. Seminal cytokine concentrations (IL-1 , IL-2, IL-6, sR IL-2, sR IL-6), semen parameters and blood hormonal status in male infertility. Hum Reprod 1997;12(7):1476-1479.
19. Heidargholizadeh S., Aydos S.E., Yukselten Y., Ozkavukcu S., Sunguroglu A, Aydos K. A differential cytokine expression profile before and after rFSH treatment in Sertoli cell cultures of men with nonob- structive azoospermia. Andrologia. 2017;49(4):e12647.
20. Lotti F., Corona G., Mondaini N., et al. Seminal, clinical and colour- Doppler ultrasound correlations of prostatitis-like symptoms in males of infertile couples. Andrology 2014;2(1):30-41
21. An L.F., Zhang X.H., Sun X.T., Zhao L.H., Li S., Wang W.H. Unexplained infertility patients have increased serum IL-2, IL-4, IL-6, IL-8, IL-21, TNF , IFN and increased Tfh/CD4T cell ratio: Increased Tfh and IL-21 strongly correlate with presence of autoantibodies. Immunol Invest. 2015;44(2):164-173.
22. Alsaimary IEA. Evaluation of serum levels of pro-inflammatory cytokines (interleukins 2, 6, 8) in fertile and infertile men. Donnish J Microbiol Biotechnol Res 2014;1(2):23-34.
23. Hagan S., Khurana N., Chandra S. et al. Differential expression of novel biomarkers (TLR-2, TLR-4, COX-2, and Nrf-2) of inflammation and oxidative stress in semen of leukocytospermia patients. Andrology. 2015;3(5):848-55. Doi: 10.1111/andr.12074.
24. Agarwal A., Prabakaran S.A. Said T.M. Prevention of oxidative stress injury to sperm. J Androl. 2005;26:654-660.
25. Dziadecki W., Celinska A., Fracki S., Bablok L., Barcz E. Interleukin 6 and interleukin 8 concentrations in seminal plasma of male with seminogram abnormalities. Centr Eur J Immunol 2010;35:162-167.
26. Bukharin O.V., Kuzmin M.D., Perunova N.B., etc. Characteristics of microbiota and cytokine profile of sperm plasma in men with chronic bacterial prostatitis. Urologiia. 2020;(5):67-72. Russian (Бухарин О.В., Кузьмин М.Д., Перунова Н.Б. и др. Характеристика микробиоты и цитокинового профиля плазмы сперматозоидов у мужчин с хроническим бактериальным простатитом. Урология. 2020;(5):67- 72).
27. Бухарин О.В., Кузьмин М.Д., Перунова Н.Б. и соавт. Диагностический цитокиновый маркер мужского бесплодия - интерлейкин 4. Клин Лабораторная диагностика. 2022;67(3):151-157. Doi: 10.51620/0869¬2084-2022-67-3-151-157.
28. Daniela Andrea Paira, Silene Silvera-Ruiz, Andrea Tissera et al. Interferon—Y, IL-17, and IL-ie impair sperm motility and viability and induce sperm apoptosis. Cytokine. 2022;152:155834. Doi: 10.1016/j.cyto.2022.155834. Epub 2022 Feb 22.
29. Farzaneh Fesahat, Efat Norouzi, Seyed Mohammad Seifati et al. Impact of Vitamin C on Gene Expression Profile of Inflammatory and Anti-Inflammatory Cytokines in the Male Partners of Couples with Recurrent Pregnancy Loss. Int J Inflam. 2022;2022:1222533. Doi: 10.1155/2022/1222533.
30. Sukhikh G.T., Popova A.Yu., Ovchinnikov R. I., Ushakova I.V. The effect of the Proton complex on the functional characteristics of spermatozoa in men with idiopathic pathozoospermia. Reproduction problems. 2016;4:106-109. Russian (Сухих Г.Т., Попова А.Ю., Овчинников РИ., Ушакова И.В. Влияние комплекса Сперотон на функциональные характеристики сперматозоидов у мужчин с идиопатической патозооспермией. Проблемы репродукции. 2016;4:106-109).
31. Smits R.M., Mackenzie-Proctor R., Yazdani A., et al. Antioxidants for male subfertility. Cochrane Database Syst Rev. 2019;3(3):CD007411. Doi: 10.1002/14651858.CD007411.pub4.
32. Ovchinnikov R.I., Popova A.Yu., Gamidov S.I. Antioxidant therapy is the key to the treatment of idiopathic male infertility. 2017;20:177-181. Russian (Овчинников Р.И., Попова А.Ю., Гамидов С.И. Антиоксидантная терапия - ключ к лечению идиопатического мужского бесплодия. 2017;20:177-181). Doi: 10.21518/2079-701X-2017-20-177-181.
33. Gamidov S.I., Ovchinnikov R.I., Popova A.Yu. Double-blind randomized placebo-controlled study of the efficacy and safety of acetyl-L-carnitine complex, L-carnitine fumarate and alpha-lipoic acid (SpermActin ® Forte) in the treatment of male infertility. Urology. 2019;4:62-68. Russian (Гамидов С.И., Овчинников Р.И., Попова А.Ю. Двойное слепое рандомизированное плацебо-контролируемое исследование эффективности и безопасности комплекса ацетил-1.-карнитина, L-карнитина фумарата и альфа-липоевой кислоты (СпермАктин® Форте) в лечении мужского бесплодия. Урология. 2019;4:62-68). Doi: 10.18565/urology.2019.4.61-68.
34. Burton G.W., Traber M.G. Vitamin E: Antioxidant activity, biokinetics, and bioavailability. Annu Rev Nutr 1990;10:357-382.
35. Keskes-Ammar L., Feki-Chakroun N., Rebai T., Sahnoun Z., Ghozzi H., Hammami S., et al. Sperm oxidative stress and the effect of an oral Vitamin E and selenium supplement on semen quality in infertile men. Arch Androl 2003;49:83-94.
36. Ahsan U., Kamran Z., Raza I., Ahmad S., Babar W., Riaz M.H., et al. Role of selenium in male reproduction - A review. Anim Reprod Sci 2014;146:55- 62.
37. Lenzi A., Lombardo F., Sgro P., Salacone P., Caponecchia L., Dondero F., Gandini L. Use of carnitine therapy in selected cases of male factor infertility: A double-blind crossover trial. Fertil. Steril. 2003;79:292-300.
38. Instructions for the use of the drug Mexidol. Russian (Инструкция по применению препарата Мексидол). https://www.rlsnet.ru/tn_index_ id_679.htm
39. Gamidov S.I., Ovchinnikov R.I., Popova A.Yu. et al. Adjuvant antioxidant therapy in infertility patients with varicocele. Urologiia. 2017;2 (Adj. 2):64-72. Russian (Гамидов С.И., Овчинников Р.И., Попова А.Ю. и др. Адъювантная антиоксидантная терапия у больных бесплодием при варикоцеле. Урология. 2017;2(Прил. 2):64-72). Doi: https://dx.doi. org/10.18565/urol.2017.2-supplement.64-72.
40. Harris M., Taylor G. Medical statistics made easy. London: Taylor and Francis; 2006.
41. Korneev I.A. Male infertility under oxidative stress: ways to solve the problem. Urologiia. 2022;1:102-108. Russian (Корнеев И.А. Мужское бесплодие при оксидативном стрессе: пути решения проблемы. Урология 2022;1:102-108). Doi: https://dx.doi.org/10.18565/ urology.2022.1.102-108
42. Agarwal A., Parekh N., Panner Selvam M.K., Henkel R., Shah R., et al. Male Oxidative Stress Infertility (MOSI): Proposed Terminology and Clinical Practice Guidelines for Management of Idiopathic Male Infertility. World J Mens Health. 2019;37(3):296-312. Doi: 10.5534/wjmh.190055.












