Фарматека №13 (207) / 2010
Применение нимесулида в ревматологии
Рассматриваются особенности нимесулида (Найза) в сравнении с другими нестероидными противовоспалительными препаратами (НПВП). Установлено, что нимесулид относится к группе частично селективных НПВП, для которых характерно преимущественное подавление ЦОГ-2. Обсуждаются механизмы действия нимесулида при ревматических заболеваниях, в частности при остеоартрозе. Приводятся данные о его высокой клинической эффективности и безопасности. Подчеркивается, что нимесулид является эффективным препаратом для лечения заболеваний суставов и позвоночника: оказывает быстрое и выраженное анальгетическое и противовоспалительное действия; не обладает хондротоксическими свойствами; по частоте нежелательных эффектов сравним с большинством наиболее часто используемых НПВП.
Заболевания суставов и позвоночника представляют значительную проблему для современной медицины, т. к. способствуют развитию функциональной недостаточности опорно-двигательного аппарата и как следствие – снижению илипотере трудоспособности. При этом какпричина инвалидизации больных заболевания суставов занимают 3-е место(после сердечно-сосудистых и онкологических).
Основным симптомом данной группызаболеваний является боль в суставахи спине. И поскольку распространенность различных заболеваний опорно-двигательного аппарата неуклонно растет, отмечается рост потреблениянаселением анальгетиков и нестероидных противовоспалительных препаратов(НПВП).
НПВП – группа лекарственныхпрепаратов с различной химическойструктурой, обладающих анальгетическими, противовоспалительными ижаропонижающими свойствами. Послеприема внутрь все НПВП практическиполностью всасываются в желудочно-кишечном тракте (ЖКТ), а их активные метаболиты обладают высокой тропностью к белкам плазмы (преимущественно альбуминам). Выводятся НПВП восновном через почки. Препараты данной группы различаются по скорости наступления лечебного эффекта, определяемой временем достижения максимальной концентрации в плазме, и подлительности эффекта, зависящей отвремени полувыведения препарата.Механизм действия НПВП связан свмешательством в метаболизм арахидоновой кислоты, который, как известно, может идти по двум путям, важнейшееместо в котором занимает циклооксигеназа (ЦОГ; рис. 1).
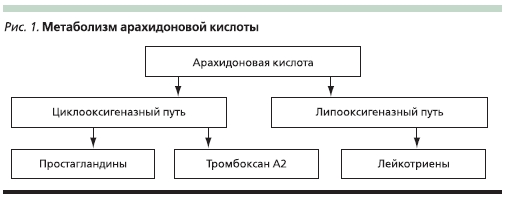
ЦОГ может существовать в виде двухизоформ – ЦОГ-1 и ЦОГ-2. ПричемЦОГ-1 является источником синтезапростагландинов (ПГ), обеспечивающих физиологическую работу клеток, ипостоянно присутствует в большинстветканей организма человека, в то время как ЦОГ-2 синтезируется при различных воспалительных процессах и способствует синтезу провоспалительныхПГ, накапливающихся в очаге воспаления [1, 2]. ПГ характеризуются широкимспектром действия: являясь медиаторами воспаления, они обладают вазодилатирующими свойствами, повышаютпроницаемость сосудов; способствуяразвитию отека и экссудации, потенцируют действие гистамина и брадикини-
на; снижают порог болевой чувствительности, а также оказывают центральноедействие – повышают чувствительность центров гипоталамуса к действиюпирогенов.
В последние годы отмечается ростинтереса к роли ЦОГ-2 в развитиигиперальгезии, что вызвано полученными данными об увеличении концентрации фермента в очаге воспаления, атакже его экспрессии в спинном мозге.Считается, что противовоспалительный эффект НПВП связан именно с ингибированием ЦОГ-2, а развитиепобочных явлений – с блокадой ЦОГ-1.В связи с этим особого вниманиязаслуживают НПВП, механизм действия которых заключается в подавлении ЦОГ-2. Согласно рекомендациямAHRQ (Agency for Healthcare Quality andResearch), все НПВП могут быть разделены на неселективные, селективные ЦОГ-2 ингибиторы (класс коксибов)и частично селективные (с преимущественным подавлением ЦОГ-2) [3].К последней группе препаратов относится нимесулид.
Нимесулид был создан в 1980 г., он относится к классу сульфонанилидов. Препарат обладает высокой биодоступностью, после перорального приема 50%-ная концентрация нимесулида в плазмедостигается уже через 30 минут, а максимальная концентрация – через 1,5–2,5 часа, благодаря чему препарат оказываетдовольно быстрое анальгетическое действие [4, 5]. Нимесулид связывается сбелками плазмы на 95 %, подвергается биотрансформации в печени и выводится через почки и кишечник. Периодполураспада нимесулида составляет от1,8 до 4,7 часа, но ингибиция ЦОГ-2сохраняется до 8,0 часов (в синовиальной жидкости – до 12,0) [6]. Механизм действия нимесулида включает:
• подавление высвобождения гистамина из базофилов и тучных клеток;
• блокирование протеинкиназы С ифосфодиэстеразы 4-го типа, приводящее к ингибированию продукциисупероксидных радикалов;
• ингибирование синтеза металлопротеиназ;
• ингибирование активности протеаз;
• подавление синтеза интерлейкина-1 и фактора активации тромбоцитов;
• подавление высвобождения факторанекроза опухоли α.
Нимесулид был подробно изучен вряде клинических исследований. Одноиз них – исследование Kullich W.C. исоавт. [7], в которое были включены20 пациентов с гонартрозом и/иликоксартрозом II–IV стадий и выраженной болью в суставах. Группу контролясоставили 22 добровольца без артралгий. Больные принимали нимесулид в дозе200 мг/сут в течение 3 недель.
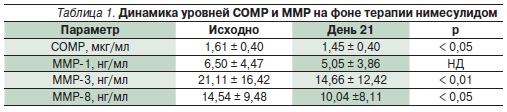
Помимо доказательства клиническойэффективности нимесулида в исследовании были получены важные данныео механизме действия препарата. Присравнении со здоровыми добровольцами у больных остеоартрозом (ОА) нафоне приема нимесулида отмеченодостоверное снижение уровня олигомерного матриксного протеина (COMP)и металлопротеиназ (ММР) 3 и 8 в сыворотке крови через 3 недели терапии.Концентрация ММР-1 также снижалась, но статистически недостоверно (табл. 1).