Акушерство и Гинекология №9 / 2018
Применение омиксных технологий в решении проблем репродуктивной медицины
ФГБУ Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова Минздрава России, Москва
Проведен систематический анализ данных, имеющихся в современной литературе, о возможности оценки репродуктивного здоровья по метаболомному, протеомному и транскриптомному профилю половых клеток и эмбриона на ранних стадиях развития с целью усовершенствования протоколов программ вспомогательных репродуктивных технологий (ВРТ). В последние годы пристальное внимание ученых обращено к применению «омиксных» технологий для оценки фертильности организма. Приведены результаты оценки жизнеспособности эмбрионов по метаболомному профилю – анализ содержания углеводов и аминокислот в среде культивирования эмбриона; протеомному профилю – анализ белкового спектра в полости бластоцели, секретома бластоцисты; транскриптомному профилю – исследование малых некодирующих РНК во время оогенеза, сперматогенеза и раннего эмбрионального развития. Результаты проводимых исследований подтверждают перспективность и актуальность анализа белкового, метаболомного и транскриптомного профилей как бластоцели, так и культуральной жидкости бластоцисты для создания молекулярного портрета эмбрионов с различными морфометрическими показателями и для разработки диагностических и прогностических тест-систем по оценке жизнеспособности эмбриона и его имплантационного потенциала в рамках проведения программ ВРТ.
В настоящее время значительное число браков является бесплодными и их количество с каждым годом растет. При лечении различных видов бесплодия широкое распространение получили вспомогательные репродуктивные технологии (ВРТ), так как по сравнению с другими доступными методами лечения бесплодия ВРТ наиболее эффективны и имеют высокие показатели наступления беременности и рождения живых детей. Тем не менее, лишь 32,3% циклов ВРТ, проведенных впервые у женщин до 37 лет, заканчиваются рождением здорового ребенка. Частота рождения ребенка у пациенток старшего репродуктивного возраста в первом цикле ЭКО не превышает 12,3% [1].
Помимо правильно подобранной схемы стимуляции, положительный результат в программах ВРТ зависит от качества переносимого эмбриона и рецептивности эндометрия [2]. Имплантация эмбриона в эндометрий – многоэтапный процесс, опосредованный многоуровневой регуляцией внутри- и межклеточных взаимодействий, необходимой для дальнейшего развития бластоцисты, распознавания беременности и адаптации к ней организма матери.
Несмотря на то, что наступление беременности в программах ВРТ зависит от многих факторов, выбор наиболее качественного и жизнеспособного эмбриона для переноса в полость матки – одна из наиболее важных задач. Селекция эмбрионов с наибольшим имплантационным потенциалом, как правило, производится на основании визуальной оценки их морфологических свойств. Оценка морфологических параметров подразумевает измерение размера эмбриона, изучение его внутренней клеточной массы и трофэктодермы. Однако не все эмбрионы «хорошего» морфологического качества успешно имплантируются, в связи с чем возникает необходимость внедрения дополнительных неинвазивных технологий селективного выбора эмбриона с высоким имплантационным потенциалом [3]. Безусловно, нарушения имплантации могут быть связаны не только с «эмбриональными», но и с «материнскими» факторами. Материнские факторы включают анатомические аномалии матки (3,5% женщин, страдающих бесплодием), тромбофилию (20% женщин, страдающих бесплодием), нарушение рецептивности эндометрия (10–15% случаев бесплодия) и иммунологические факторы (5–15% случаев бесплодия в паре) [4].
За последние годы было изучено значительное число потенциальных биомаркеров качества эмбрионов и их имплантационной способности. Достаточно многообещающим методом выступает предимплантационный генетический скрининг (ПГС), но он остается дорогим и инвазивным. Поэтому продолжается поиск маркеров, которые дополнят общепринятый стандарт оценки качества эмбриона и его имплантационного потенциала. Основными требованиями, предъявляемыми к потенциальным маркерам, являются возможность оценки качества эмбриона без инвазивных вмешательств, четкие и воспроизводимые количественные характеристики, применимость в рутинной клинической практике [5].
Способы оценки качества эмбрионов в рутинной клинической практике
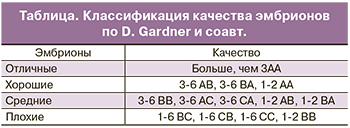 Жизнеспособность эмбрионов при культивировании зависит от трех ключевых параметров: температуры, рН и осмолярности культуральной среды. Развитие до стадии бластоцисты не обязательно происходит по строго определенному графику. Было показано, что скорость развития эмбриона коррелирует с его способностью к свободному выходу из прозрачной оболочки. Независимо от особенностей среды, в которой протекало развитие эмбриона, в идеале через 120 ч (на 5-й день) здоровый человеческий эмбрион должен достичь стадии бластоцисты. Развитие эмбриона на ранних стадиях обеспечивается благодаря трансляции материнских мРНК, происходящих из яйцеклетки. Собственный геном эмбриона человека активируется через несколько дней после оплодотворения. На 5 день своего развития эмбрион должен состоять из 50–200 клеток, 20–30% которых приходится на внутреннюю клеточную массу, а 70% – на трофобласт. В соответствии с рекомендациями Стамбульского Консенсуса, качественная оценка эмбрионов должна включать в себя морфокинетические характеристики и плоидность. В рутинной клинической практике для оценки качества эмбриона применяются морфологические критерии Gardner и соавт. (таблица) [6]. Данные критерии включают в себя оценку внутренней клеточной массы, трофэктодермального слоя, прозрачной оболочки, а также скорость развития бластоцисты.
Жизнеспособность эмбрионов при культивировании зависит от трех ключевых параметров: температуры, рН и осмолярности культуральной среды. Развитие до стадии бластоцисты не обязательно происходит по строго определенному графику. Было показано, что скорость развития эмбриона коррелирует с его способностью к свободному выходу из прозрачной оболочки. Независимо от особенностей среды, в которой протекало развитие эмбриона, в идеале через 120 ч (на 5-й день) здоровый человеческий эмбрион должен достичь стадии бластоцисты. Развитие эмбриона на ранних стадиях обеспечивается благодаря трансляции материнских мРНК, происходящих из яйцеклетки. Собственный геном эмбриона человека активируется через несколько дней после оплодотворения. На 5 день своего развития эмбрион должен состоять из 50–200 клеток, 20–30% которых приходится на внутреннюю клеточную массу, а 70% – на трофобласт. В соответствии с рекомендациями Стамбульского Консенсуса, качественная оценка эмбрионов должна включать в себя морфокинетические характеристики и плоидность. В рутинной клинической практике для оценки качества эмбриона применяются морфологические критерии Gardner и соавт. (таблица) [6]. Данные критерии включают в себя оценку внутренней клеточной массы, трофэктодермального слоя, прозрачной оболочки, а также скорость развития бластоцисты.
Согласно классификации Gardner и соавт. цифрой обозначена степень зрелости бластоцисты:
- 1-я степень – ранняя бластоциста, полость бластоцисты меньше половины объема эмбриона;
- 2-я степень – полость бластоцисты больше половины объема эмбриона;
- 3-я степень – полная бластоциста, полость полностью занимает объем эмбриона;
- 4-я степень – расширенная бластоциста, полость бластоцисты становится больше и начинает истончаться прозрачная оболочка;
- 5-я степень – трофэктодерма начинает проникать через прозрачную оболочку;
- 6-я степень — вылупившаяся бластоциста, покинувшая zona pellucida (ZP).
Первая б...












