Кардиология №11 / 2015
Прогностические факторы сердечно-сосудистых осложнений после ишемического инсульта
ФГБНУ Научный центр неврологии, Москва
В проспективное когортное наблюдательное исследование включены 148 пациентов, перенесших ишемический инсульт (ИИ), в возрасте 60 (52; 68) лет. Длительность проспективного наблюдения составила 35 (28; 40) мес. В качестве суммарной конечной точки регистрировали повторный инсульт, транзиторные ишемические атаки, инфаркт миокарда, нестабильную стенокардию, острую сердечную недостаточность, острую декомпенсацию хронической сердечной недостаточности, потребовавшую госпитализации, все случаи сердечно-сосудистой смерти. За время наблюдения у 37 (25%) пациентов зарегистрировано 50 сердечно-сосудистых осложнений (ССО). По данным многофакторного регрессионного анализа, независимыми предикторами ССО после ИИ явились возраст старше 67 лет, наличие хронической ишемической болезни сердца, желудочковых аритмий высоких градаций, стандартное отклонение кардиоинтервалов (SDNN) менее 71 мс, отсутствие тиазидных или тиазидоподобных диуретиков в схеме базисной антигипертензивной терапии.
Инсульт вследствие высокой распространенности и тяжелых последствий представляет важнейшую медико-социальную проблему. Продолжительность жизни пациента, перенесшего первый инсульт, составляет в среднем 8,8 года, а в случае развития повторного инсульта или инфаркта миокарда (ИМ) этот показатель может уменьшаться до 3,9 года. При этом у пациентов после впервые возникшего инсульта риск повторных острых нарушений мозгового кровообращения повышен в 9 раз, а риск развития ИМ, включая внезапную сердечную смерть (ВСС), — в 2—3 раза [1, 2].
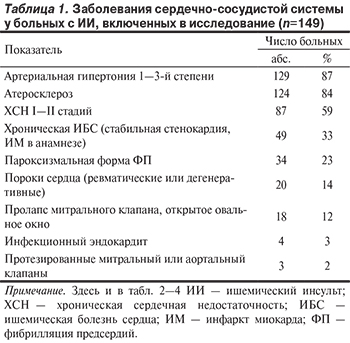
Известен ряд предикторов сердечно-сосудистых осложнений (ССО) в отдаленные сроки после инсульта, таких как пожилой возраст, мужской пол, курение, артериальная гипертензия (АГ), мультифокальный атеросклероз, фибрилляция предсердий (ФП), сахарный диабет, выраженность неврологических расстройств и т.д. [3]. Активно изучается состояние вариабельности ритма сердца (ВРС) как фактора риска ВСС и коронарных осложнений у пациентов с ишемическим инсультом (ИИ) [4, 5]. Кроме того, для прогнозирования ССО после ИИ применялся ряд стандартных моделей [6]. Однако Фрамингемская шкала, с успехом используемая в кардиологической практике, не позволила обнаружить ассоциации между расчетным риском и частотой развития повторного инсульта, так как не учитывает специфические факторы риска развития ИИ — ФП, каротидный атеросклероз [7]. Другие шкалы основывались на изучении ограниченного контингента пациентов (не включались больные с кардиоэмболическим или повторным инсультом) и небольшой длительности наблюдения (1—2 года) [6, 8], тогда как риск развития повторных инсультов и всех ССО сохраняется повышенным на протяжении 10 лет и более после ИИ [9].
В настоящее время, несмотря на достижения превентивной медицины и разработку единой стратегии вторичной профилактики после ИИ, прогноз у больного остается хуже ожидаемого [4, 10]. Для более результативного планирования мероприятий по профилактике ССО необходим интегративный поиск предикторов высокого риска развития ССО в отдаленном постинсультном периоде.
 Цель данного исследования заключалась в установлении прогностических факторов ССО после ИИ.
Цель данного исследования заключалась в установлении прогностических факторов ССО после ИИ.
Материал и методы
В проспективное когортное наблюдательное исследование включали пациентов, последовательно поступивших во 2-е неврологическое отделение ФГБНУ НЦН. Критерии включения: мужчины и женщины в возрасте 20—85 лет; ИИ в первые 20 сут заболевания; синусовый ритм сердца; подписанное информированное согласие. Критерии отказа от включения: постоянная форма ФП, искусственный водитель ритма, деменция, онкологические заболевания, тяжелая соматическая патология, отсутствие возможности связи для поддержания контакта с пациентом или его родственниками.
Протокол исследования одобрен локальным Этическим комитетом ФГБНУ НЦН.
Всего в наблюдение были включены 148 человек, из них 94 (64%) мужчины и 54 (36%) женщины, возраст пациентов на момент включения в исследование варьировал от 22 до 83 лет, медиана — 60 (52; 68) лет.
На стационарном этапе было проведено детальное обследование. Клинический диагноз, включая определение патогенетического подтипа инсульта, базировался на данных анамнеза, результатах клинико-инструментального исследования с оценкой неврологического, кардиологического и соматического статуса, лабораторных тестов.
Всем больным выполнена магнитно-резонансная либо компьютерная томография головы, с напряженностью магнитного поля 1,5 Т. Оценивали величину и локализацию ишемического очага. При наличии 3 церебральных ишемических очагов и более поражение мозга считали множественным.
Состояние брахиоцефальных артерий (БЦА) исследовали методом дуплексного сканирования. Оценивали наличие, характер и степень выраженности структурных изменений артерий (увеличение толщины интимы—медии, атеросклеротическое поражение, деформации, патологическая извитость). Гемодинамически значимыми считали стенозы, превышающие 70% диаметра просвета артерии.
Степень выраженности неврологического дефицита определяли с помощью Скандинавской шкалы, на которой 0 соответствует максимально выраженным расстройствам, а 60 баллов — отсутствию неврологического дефицита. Степень функциональной состоятельности и выраженности нарушений жизнедеятельности по окончании острого периода инсульта оценивали с помощью модифицированной шкалы Рэнкин, в которой оценка варьирует от 0 (отсутствие неврологической симптоматики) до 5 баллов (прикованные к постели пациенты, нуждающиеся в постоянной заботе и внимании).
Всем больным выполнена трансторакальная эхокардиография с оценкой состояния камер и клапанов сердца, систолической и диастолической функции левого желудочка (ЛЖ).
Холтеровское мониторирование (ХМ) электрокардиограммы (ЭКГ) осуществляли с использованием портативного регистратора с непрерывной трехканальной записью ЭКГ в течение 24 ч. С помощью ХМ выявляли нарушения, сопряженные с повышенным риском развития ССО: пароксизмальную форму ФП, желудочковую экстрасистолию (ЖЭ), пароксизмальную желудочковую тахикардию (Ж...












