Фарматека №7 / 2019
Прогностическое и предиктивное значения мутации гена PIK3CA у больных раком молочной железы
1) Национальный медицинский исследовательский центр онкологии им. Н.Н. Петрова, Санкт-Петербург, Россия;
2) Северо-Западный государственный медицинский университет им. И.И. Мечникова, Санкт-Петербург, Россия;
3) ООО «Новартис Фарма», Москва, Россия
Принципы лечения HR+-HER2-метастатического рака молочной железы (мРМЖ) в течение длительного периода времени оставались неизменными. Последовательное применение различных вариантов эндокринотерапии обеспечивало значимое увеличение показателей общей и безрецидивной выживаемости при сохранении высокого качества жизни. Однако с течением времени пациенты прогрессируют в связи с развитием резистентности к проводимому лечению. Изучение причин и способов преодоления резистентности к гормонотерапии привело к раскрытию новых мощных возможностей лечения пациентов с HR+-HER2-мРМЖ. В развитии невосприимчивости к эндокринной терапии фундаментальная роль отведена перекрестным взаимодействиям различных сигнальных каскадов в клетке в результате приобретенных мутаций рецепторов эстрогенов. Нарушение функционирования PI3K-опосредованного каскада представляет собой самое частое нарушение при РМЖ и ассоциировано с резистентностью к эндокринной терапии. Фосфатидил-инозитол-3 киназа (PI3K) уже много лет привлекает пристальное внимание ученых как ключевой координатор процессов роста и жизнедеятельности клетки. В текущем обзоре приведены основные положения, характеризующие клиническую значимость мутации гена PIK3CA, кодирующего киназу PI3K: прогностическая и предиктивная роль мутации гена PIK3CA (PIK3CA+) во всех подтипах РМЖ; а также обосновывается выделение особой группы пациентов, нуждающихся в терапии, подавляющей активность PI3K.
Для цитирования: Семиглазова Т.Ю., Сорокина И.В. Прогностическое и предиктивное значения мутации гена PIK3CA у больных раком молочной железы. Фарматека. 2019;26(7):10–20. DOI: https://dx.doi.org/10.18565/pharmateca.2019.7.10-20
Универсальная роль фосфатидил-инозитол-3-киназы
За последние 20 лет было предпринято множество попыток создания эффективного и безопасного ингибитора фосфатидил-инозитол-3-киназы (PI3K). Однако комплексная и мультифункциональная роль PI3K в процессах жизнедеятельности клетки я стали причиной многих таких попыток и неудач.
Молекулярный каскад PI3K/Akt/mTOR представляет собой ключевую и универсальную систему, характерную для большинства клеток человека. PI3K/Akt/mTOR вовлечен в регуляцию основных процессов жизнедеятельности клетки, включая рост, пролиферацию и выживание [1]. На сегодняшний день результаты множества исследований данного сигнального пути являются PI3K, протеинкиназа B (Akt, англ. RAC-alpha serine/threonine-protein kinase, Protein kinase B alpha) и молекулярная мишень рапамицина млекопитающих (mTOR, англ. mammalian target of rapamycin).
Семейство фосфатидил-инозитол-3-киназ – один из важнейших регуляторных белков, находящихся на пересечении различных сигнальных путей и контролирующих ключевые функции клетки [3]. Обнаруженная у PI3K двойная ферментативная активность (липид- и протеинкиназная), а также способность активировать ряд сигнальных белков определяют принципиальное значение PI3K в регуляции таких функций клетки, как метаболизм, дифференцировка, миграция, рост, выживаемость, старение и онкогенная трансформация [4].
Строение и тканевая специфичность PI3K
Семейство PI3K представлено 3 классами (I, II и III), которые отличаются по структурной организации, субстратной специфичности и функциям в клетке. Причем среди всех классов класс I семейства PI3K играет важную роль в процессе онкогенной трансформации [4].
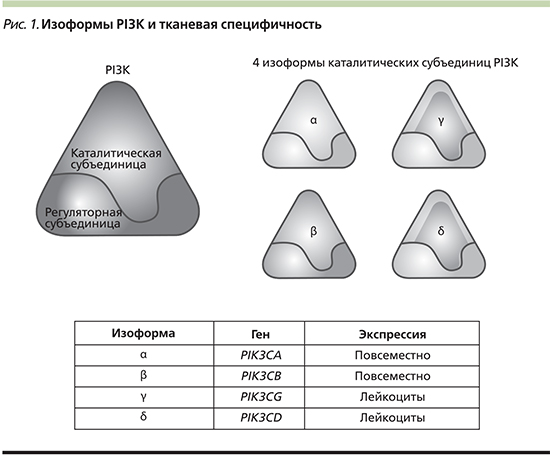
Молекула PI3K представляет собой гетеродимер и состоит из двух субъединиц: каталитической и регуляторной, каждая из которых кодируется разными генами (рис. 1). Молекула PI3K класса IA представлена комплексом из каталитической субъединицы р110 (изоформы р110α, р110β, р110γ, р110δ) и регуляторной субъединицы р85 (изоформы р85α, р55α, р50α), р85β и р55γ) и вовлечена непосредственно в канцерогенез [5]. Гомологичные субъединицы p110α, p110β и p110δ кодируются генами PIK3CA, PIK3CB и PI3KCD соответственно. Класс IB представлен геном PIK3CG, который кодирует каталитическую субъединицу p110γ [6]. Изоформы p110α и p110β экспрессируются во всех тканях организма, в то время как экспрессия p110δ и p110γ ограничена только гематопоэтическими и иммунными клетками [4].
Онкогенная активация PI3K-Akt-mTOR молекулярного каскада
Онкогенная активация сигнального каскада PI3K-Akt-mTOR наряду с патологическим функционированием MAPK-опосредованного пути считаются одними из самых частых нарушений, наблюдающихся на различных этапах канцерогенеза (рис. 2). Аномальная активация PI3K-Akt-mTOR может быть реализована минимум тремя независимыми путями. Во-первых, молекула PI3K воспринимает и опосредует множество внеклеточных сигналов, поступающих от активированных факторами ростами рецепторов на поверхности клетки (таких, как IGF-1, EGFR, HER2, VEGF, ALK, c-Met, c-Kit, PDGF, TGFα; рис. 2) [2, 7, 8–10]. При взаимодействии фактора роста с рецептором тирозинкиназы происходит димеризация последнего. Далее образуется комплекс димера с регуляторной субъединицей PI3K–р85, что служит триггером для активации каталитической субъединицы р110α, в дальнейшем – и всего сигнального каскада. При избыточном поступлении ростовых факторов или наличия активирующей мутации в генах, кодирующих рецепторы тирозинкиназ, происходит постоянная активация PI3K, а следовательно, и сигнального пути PI3K-Akt-mTOR (рис. 2).

Другой причиной патологического функционирования PI3K-Akt-mTOR является потеря активности или подавление экспрессии генов, кодирующих негативный регулятор молекулярного каскада, онкосупрессор, белок PTEN. Потеря функции PTEN часто коррелирует с конститутивной активацией молекулы mTOR, привнося свой вклад в развитие неоплазии [11].
Амплификация или мутация в гене PIK3CA, кодирующем α-изоформу каталитической субъединицы р110-PI3K, относится к одной из наиболее распространенных причин гиперактивации PI3K-опосредованного сигнального каскада [11]. Мутации гена PIK3CA (PIK3CA+) являются соматическими и встречаются с различной частотой во многих опухолях человека, включая РМЖ, рак простаты, колоректальный рак, рак матки, рак яичников, рак легкого, опухоли головы и шеи, лимфомы, рак поджелудочной железы, рак желудка, рак пищевода, рак щитовидной железы, рак печени и глиобластому [12, 13].
PIK3CA+ приводит к развитию процессов онкогенной трансформации, являясь причиной конститутивной стимуляции сигнального каскада PI3K–Akt–mTOR независимо от наличия факторов роста и активации рецепторов тирозинкиназ [6]. В ряде исследований доказано, что наличие PIK3CA+ ассоциировано с резистентностью к таргетной терапии, направленной на подавление функции рецепторов факторов роста (к терапии












