Фарматека №2 (315) / 2016
Прогноз лейкопении и нейтропении у больных хроническим гепатитом С на фоне противовирусной терапии с применением ингибиторов протеазы 1-го и 2-го поколений
(1) ГБУЗ «Московский клинический научно-практический центр» ДЗ г. Москвы; (2) Медицинский институт усовершенствования врачей МГУПП, Москва
Введение
Несмотря на колоссальный прогресс в терапии хронического гепатита С (ХГС) за последние десятилетия, актуальность данной проблемы не снижается. Стабильно высокий уровень заболеваемости, отсутствие вакцины, верификация заболевания на поздних стадиях, формирование гепатоцеллюлярной карциномы (ГЦК), необходимость в трансплантации печени влекут за собой существенные экономические затраты государства на диагностику и лечение основного заболевания и его осложнений [1, 2]. Кроме того, выраженный фиброз снижает шансы пациента на вероятность перенести противовирусную терапию (ПВТ) без развития серьезных осложнений, декомпенсации цирроза печени и в конечном счете – излечение от гепатита С.
В настоящее время в России для лечения хронической HCV-(hepatitis C virus)-инфекции 1-го генотипа доступны различные схемы. К вариантам, содержащим интерферон (ИФН), относится тройная комбинированная терапия пегилированным интерфероном α и рибавирином (ПЕГ-ИФН-α+РБВ) с применением ингибиторов протеазы (ИП) 1-го поколения (боцепревир или телапревир) и ИП 2-го поколения – симепревир. Внедрение в практику схем с препаратами прямого противовирусного действия (ПППД) позволило повысить устойчивый вирусологический ответ (УВО) с 45–50% на ПЕГ-ИФН-α+РБВ до 63–66% для пациентов, ранее не получавших лечения, 69–75% – c рецидивом, 40–52% – с предшествующим частичным и 38% – с «нулевым» ответом при применении боцепревира [3, 4]. В российской популяции применение телапревира пациентами с фиброзом и циррозом позволило достигнуть 82% УВО больным, ранее не получавшим лечения, 96% – с рецидивом и 67% пациентам с «нулевым» ответом. По мнению авторов, высокая эффективность обусловлена преобладанием в России пациентов с генотипом 1b, при котором ИП более эффективны по сравнению с генотипом 1а [5]. ИП 2-го поколения (симепревир) обладает более высоким профилем безопасности и не менее высокой эффективностью: частота УВО достигает 80,4% для пациентов, ранее не получавших лечения, 79–85% – c рецидивом, 75% – с предшествующим частичным и 51% – с «нулевым» ответом.
Согласно последним международным рекомендациям по лечению гепатита С, телапревир и боцепревир не применяются, т.к. зарегистрированы более эффективные и безопасные комбинации препаратов [6]. Кроме того, с 2015 г. доступны безинтерфероновые комбинации омбитасвир, паритапревир, дасабувир+ритонавир, а также даклатасвир и асунапревир. По результатам клинических исследований, УВО в данных комбинациях был достигнут в 90–100% и 82–91% случаев соответственно [7]. Однако во многих странах, в т.ч. и в России, для подавляющего большинства больных с учетом экономической составляющей данные комбинации оказываются недоступными. В связи с этим необходимо выделять группы больных, нуждающихся в безотлагательной терапии, и обеспечивать их доступными ИФН-содержащими схемами.
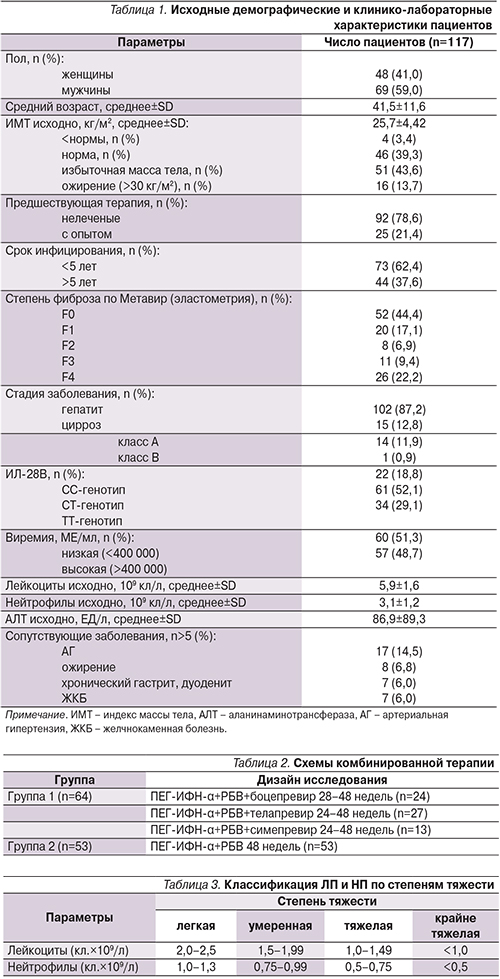
Схемы, содержащие ИФН и рибавирин в процессе лечения, могут приводить к нежелательным явлениям (НЯ), которые могут потребовать либо модификации дозировки лекарств, либо полной отмены [8]. Наиболее распространенные причины для снижения дозы – депрессии, цитопении, нарушения функции щитовидной железы [9].
Особое место среди этих НЯ занимают лейкопения (ЛП) и нейтропения (НП), развивающиеся из-за миелосупрессивного эффекта ПЕГ-ИФН-α+РБВ [10]. Гематологические НЯ не только ухудшают качество жизни пациентов, но и могут быть причиной развития инфекционных осложнений, которые требуют коррекции или отмены ПВТ, сопровождаются снижением частоты достижения УВО [11].
Результаты многочисленных исследований показывают, что ЛП и НП служат наиболее частой причиной модификации ПЕГ-ИФН-α+РБВ во время ПВТ. Частота возникновения НП (<750×109/л) на фоне терапии ПЕГ-ИФН-α+РБВ, по разным данным, составляет 18–21%. Согласно российским инс...












