Клиническая Нефрология №2 / 2016
Прогнозирование результатов трансплантации почки
1 ГБУЗ СО «Свердловская областная клиническая больница № 1», Екатеринбург;
2 ФБУН «Екатеринбургский медицинский научный центр профилактики и охраны здоровья рабочих промпредприятий»;
3 ФГАОУ ВПО «Уральский федеральный университет им. первого Президента России Б.Н. Ельцина», Екатеринбург
Введение
Лечение заболеваний почек и терминальной почечной недостаточности (ТПН) – одна из основных проблем современной медицины [1–3]. Распространенность хронической болезни почек (ХБП) превышает 10%, что связано как с ростом сахарного диабета (СД) и артериальной гипертензии (АГ), так и с другой почечной патологией [4, 5]. Смертность от ХБП повысилась на 82% за два последних десятилетия, став третьей среди 25 основных причин смерти по темпам роста после СПИДа и СД [3]. К 2008 г. число пациентов, получавших заместительную почечную терапию (ЗПТ) в мире, превысило 1,4 млн [6]. Расходы на 1 пациента составляют более 75 тыс. долл. в в год: от 32 922 долл. – на пациента с трансплантатом почки, до 87 945 – на пациента, получающего гемодиализ (ГД) [7, 8]. По данным регистра Российского диализного общества на 31.12.2011 [9], показатель обеспеченности ЗПТ в пересчете на 1 млн населения на 31.12.2011 в среднем по России составил 199,6 пациента (в 2008 г. – лишь 55,9 больного на 1 млн), а на 31.12.2013 – 245,7 на 1 млн [10].
Аллотрансплантация почки (АТП) является оптимальным методом ЗПТ, т.к. увеличивает продолжительность жизни больных в большей степени, чем перитонеальный гемодиализ, обеспечивает более высокое качество жизни и уровень медико-социальной реабилитации, являясь наиболее предпочтительным методом с экономической точки зрения [1, 11–15]. В настоящее время в мире ежегодно выполняют около 70 тыс. трансплантаций почки [16, 17]. Несмотря на преимущества данного вида ЗПТ, имеются многочисленные ограничения доступности трансплантации почки по всему миру: социальные, культурные, экономические [17]. Несмотря на улучшение результатов АТП в течение первых лет после операции, потери ренальных аллотрансплантатов (РАТ) в отдаленном периоде остаются значительными [16, 18, 19].
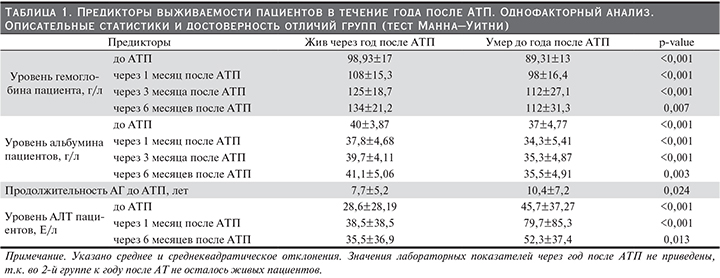
Проводится изучение ряда факторов, являющихся предиктором результатов трансплантации почки: иммунологическая совместимость, возраст донора и реципиента, длительность периода консервации, СД как основной диагноз реципиента, инфекционные осложнения, протоколы иммуносупрессивной терапии (ИМСТ), хроническая дисфункция трансплантата (ХДТ), острое отторжение и др. [12, 15, 20–23]. При наличии массы предикторов, влияющих на результаты АТП, требуется изучение как их отдельного, так и сочетанного воздействия на выживаемость пациентов и РАТ.
Цель исследования – выявление основных предикторов выживаемости пациентов и ренальных аллотрансплантатов, создание математических моделей исходов аллотрансплантации почки в раннем и позднем пострансплантационных периодах.
Материал и методы
Проведен анализ материалов наблюдений 350 пациентов, перенесших трансплантацию почки по поводу ТПН. Срок наблюдения после операции составил от 1 суток до 352 месяцев (29,3 года); средний срок наблюдения – 79,1±3,4 месяца, медиана – 68 месяцев. Мужчин наблюдалось 229 (65,4%), женщин – 121 (34,6%). Возраст пациентов составил в среднем 37,07±0,58 года (12 – 61 год, медиана – 38 лет, стандартное отклонение – 10,44).
К основным заболеваниям почек, приведшим к развитию ТПН, относятся хронический гломерулонефрит (ХГН) у 199 (50,9%) пациентов, хронический тубулоинтерстициальный нефрит у 17 (4,3%), врожденные заболевания почек и мочевыводящих путей у 23 (6,57%) пациентов, диабетическая нефропатия отмечена у 11 (2,8%) пациентов, другие нефропатии у 10 (2,86%). Диагноз основного заболевания почек не был определен (неуточненная нефропатия) у 90 (23%) человек.
До пересадки почки 343 пациента находились на гемодиализе, 7 – на перитонеальном диализе. Средняя продолжительность диализа до АТП составила 26,6±1,3 месяца (от 0 до 162 месяцев – 13,5 лет). Трансплантаций с использованием трупного донора было выполнено 342 (97,7%), от живых родственных доноров – 8 (2,29%).Первичных АТП – 338 (96,6%), повторных – 12 (3,7%). Применялось два типа забора (изъятия) трупной донорской почки: моноорганный (изымались только почки) и мультиорганный (кроме изъятия почек проводилось изъятие и других органов – печени, сердца).
Использовалось три протокола иммуносупрессивной терапии (ИМСТ): циклоспорин+преднизолон+азатиоприн (96 пациентов – 27,5%); циклоспорин+преднизолон+микофенолат (228 пациентов – 65,1%); такролимус+преднизолон+микофенолат (26 пациентов – 7,4%). В отношении 174 (44,5%) пациентов в качестве индукционной ИМСТ применялись блокаторы рецепторов интерлейкина-2 (базиликсимаб либо даклизумаб).
Часть (208 человек, 59,4%) пациентов получали профилактическую противовирусную терапию (ППВТ) препаратом валганцикловир (вальцит).
Иммунологический подбор (типирование антигенов системы HLA – А-, В- и DR-локусы) осуществлен серологическим методом (специфические сыворотки Гисанс, Москва), а также молекулярно-генетическим методом (реагенты Protrans, Германия).

Изучены следующие исходы трансплантации почки: 1 – пациент жив с функционирующим трансплан...












