Кардиология №2 / 2017
Прорыв в лечении больных с сердечной недостаточностью с низкой фракцией выброса: клиническое значение исследования PARADIGM-HF
Федеральное государственное автономное образовательное учреждение высшего образования «Российский университет дружбы народов» (РУДН), Москва
Внедрение в клиническую практику новых терапевтических стратегий, способных улучшить прогноз пациентов с сердечной недостаточностью (СН) с низкой фракцией выброса (СНснФВ) остается актуальным. Инновационным подходом является восстановление дисбаланса нейрогуморальных систем посредством ингибирования рецепторов ангиотензина II и неприлизина. В обзоре представлена роль системы натрийуретических пептидов в патофизиологии СНснФВ, исторические подходы к нейрогуморальной модуляции, клиническая фармакология первого в классе ангиотензиновых рецепторов и неприлизина ингибитора сакубитрила/валсартана. Обсуждаются результаты исследования PARADIGM-HF, в котором терапия сакубитрилом/валсартаном у пациентов с СНснФВ по сравнению с рекомендованными дозами эналаприла сопровождалась снижением риска сердечно-сосудистой смерти и госпитализаций по поводу СН на 20%, риска смерти от любой причины — на 16%, улучшением симптомов и переносимости физических нагрузок. Сакубитрил/валсартан переносился лучше эналаприла, реже вызывал кашель, гиперкалиемию или нарушение функции почек. Не наблюдалось увеличения риска ангионевротического отека. На основании результатов исследования PARADIGM-HF сакубитрил/валсартан включен в национальные и международные рекомендации по СН.
Несмотря на успехи, достигнутые в диагностике и лечении, сердечная недостаточность (СН) остается важнейшей проблемой здравоохранения, что обусловлено ее большой распространенностью, высокой частотой повторных госпитализаций, коморбидной патологии и смертности, снижением качества жизни пациентов. Распространенность СН составляет около 1—2% среди взрослого населения в экономически развитых странах и более 10% у лиц старше 70 лет [1]. В течение 5 лет от установления диагноза вследствие развития осложнений умирают 50% пациентов [2]. Основными задачами лечения больных с СН с низкой фракцией выброса (СНнФВ) являются улучшение качества жизни и уменьшение выраженности симптомов, замедление прогрессирования дисфункции сердца, а также снижение смертности. На основании результатов рандомизированных клинических исследований сформулированы рекомендации по лечению пациентов с СНнФВ [3]. Доказана эффективность ингибиторов ангиотензинпревращающего фермента (АПФ), блокаторов рецепторов ангиотензина II — БРА (при непереносимости ингибиторов АПФ), β-адреноблокаторов, антагонистов минералокортикоидных рецепторов (АМКР), и они составляют основу лечения пациентов с СНнФВ. Однако сохраняется насущная потребность в новых терапевтических стратегиях, способных изменить прогноз у пациентов с СНснФВ. В связи с этим все больший интерес вызывает стратегия модуляции натрийуретических пептидов (НУП) [4, 5].
Патофизиология СНснФВ. Нейрогуморальные системы. Неприлизин. Развитие и прогрессирование СНнФВ тесно связаны с дисбалансом нейрогуморальных систем: ренин-ангиотензин-альдостероновой системы (РААС) и системы НУП. Активация РААС приводит к вазоконстрикции, стимулирует фиброз и гипертрофию миокарда. Противоположные эффекты дают НУП. Предсердный (ПНУП) и мозговой (МНУП) НУП высвобождаются из кардиомиоцитов вследствие растяжения камер сердца при повышении в них давления. Оба данных НУП дают диуретический, натрийуретический и антигипертензивный эффекты. Механизм их действия заключается в увеличении почечного кровотока и скорости клубочковой фильтрации (СКФ) путем ингибирования реабсорбции натрия в проксимальных и дистальных канальцах нефрона. ПНУП и МНУП активируют специфические рецепторы путем стимуляции гуанилатциклазы с последующим образованием циклического гуанозинмонофосфата (цГМФ), что приводит к реализации их эффектов, в частности, вазодилатации [6]. Кроме того, НУП подавляют ренин-ангиотензиновую и симпатическую системы и снижают секрецию эндотелина, in vitro оказывают противовоспалительное, антифибротическое и антигипертрофическое влияние на кардиомиоциты. НУП разрушаются под воздействием неприлизина (нейтральной эндопептидазы). Однако неприлизин разрушает не только НУП, но и другие пептиды, такие как ангиотензин I, ангиотензин II, эндотелин-1, брадикинин, субстанция Р, вазоактивный кишечный пептид, глюкагон, нейротензин, адреномедуллин и β-амилоид [7].
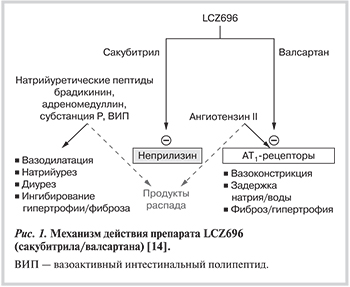 Стратегия ингибирования рецепторов ангиотензина и неприлизина. По мере прогрессирования СН чувствительность к воздействию НУП снижается. Одним из подходов нейрогуморальной модуляции при СНнФВ может быть усиление действия НУП. Фармакологические стратегии потенцирования действия НУП включали экзогенное введение пептидов, использование ингибиторов неприлизина [8]. Рекомбинантный МНУП несиритид был одобрен для лечения декомпенсации СН в США в 2001 г., однако его использование ограничено коротким периодом полувыведения, необходимостью внутривенного введения, побочными эффектами, а также не доказана его эффективность в снижении смертности [9]. Кандоксатрил, первый пероральный препарат из группы ингибиторов неприлизина, вызывал повышение артериального давления (АД) и концентрации эндотелина у здоровых добровольцев, что свидетельствовало о нецелесообразности и неэффективности изолированного ингибирования неприлизина. Учитывая вазопрессорные эффекты кандоксатрила, ряд авторов выдвинули идею о комбинации ингибиторов неприлизина с блокаторами РААС [10]. Данный подход патогенетически обоснован, если учитывать, что неприлизин разрушает не только НУП, но и ангиотензин II, при его изолированной блокаде происходит увеличение активации РААС в связи с увеличением концентрации ангиотензина II.
Стратегия ингибирования рецепторов ангиотензина и неприлизина. По мере прогрессирования СН чувствительность к воздействию НУП снижается. Одним из подходов нейрогуморальной модуляции при СНнФВ может быть усиление действия НУП. Фармакологические стратегии потенцирования действия НУП включали экзогенное введение пептидов, использование ингибиторов неприлизина [8]. Рекомбинантный МНУП несиритид был одобрен для лечения декомпенсации СН в США в 2001 г., однако его использование ограничено коротким периодом полувыведения, необходимостью внутривенного введения, побочными эффектами, а также не доказана его эффективность в снижении смертности [9]. Кандоксатрил, первый пероральный препарат из группы ингибиторов неприлизина, вызывал повышение артериального давления (АД) и концентрации эндотелина у здоровых добровольцев, что свидетельствовало о нецелесообразности и неэффективности изолированного ингибирования неприлизина. Учитывая вазопрессорные эффекты кандоксатрила, ряд авторов выдвинули идею о комбинации ингибиторов неприлизина с блокаторами РААС [10]. Данный подход патогенетически обоснован, если учитывать, что неприлизин разрушает не только НУП, но и ангиотензин II, при его изолированной блокаде происходит увеличение активации РААС в связи с увеличением концентрации ангиотензина II.
Омапатрилат был первым ингибитором неприлизина и АПФ, который продемонстрировал обнадеживающие результаты в лечении пациентов с СН [11]. Тем не менее в клинических исследованиях ангионевротический отек наблюдался чаще при использовании омапатрилата по сравнению с группой контроля. Полагают, что ангионевротический отек возникает вследствие ингибирования омапатрилатом трех ферментов, ответственных за инактивацию брадикинина: АПФ, неприлизина и аминопептидазы P [12].
Известно, что при примен...












