Урология №1 / 2015
Репродуктивная функция мужчин при хроническом простатите: клинико-анамнестические и микробиологические аспекты
1 ГБОУ ВПО «Российский университет дружбы народов»; 2 ГБОУ ВПО «Первый МГМУ им. И. М. Сеченова»; 3 ФГБУ «Поликлиника № 1» УДП РФ; 4 ГБУЗ «Городская поликлиника № 3 Департамента здравоохранения города Москвы; 5 ГБУЗ «Областная клиническая больница» Департамента здравоохранения города Иванова
Взаимосвязь между хроническим простатитом (ХП) и нарушением фертильности остается спорным вопросом. Целью исследования было изучить клинико-анамнестические и микробиологические факторы риска снижения фертильности у мужчин с ХП. Исследование было многоцентровым одномоментным ретроспективным. Проанализированы медицинские карты и компьютерные истории болезни 3174 мужчин в возрасте от 20 до 45 лет, состоявших в гетеросексуальных брачных отношениях и живших регулярной половой жизнью. Обследование пары и исследование спермы проведены в соответствии с требованиями ВОЗ. Лейкоцитоспермия имела место у 19% мужчин из бесплодных пар. Хронический простатит при этом в 54% случаев ассоциировался с аэробной бактериальной инфекцией, в 9% – с хламидийной, в 12% – с уреа- и микоплазменной. Установлено, что концентрация спермальных лейкоцитов и выраженность клинических симптомов (боль и дизурия) не являются независимыми факторами риска развития бесплодия. Для бесплодных характерно увеличение частоты встречаемости E. coli (ОШ=4,1) и появление бактериальных ассоциаций (ОШ=6,9) на фоне снижения антибактериальной резистентности спермальной плазмы (для
E. coli ОШ=9,9; для Ps. aeruginosa ОШ=6,0). Факторами риска снижения фертильности при ХП также являются продолжительность анамнеза (ОШ=2,7) и частота обострений (ОШ=2,6), наличие фиброза и простатолитов (ОШ=1,8), функциональная обструкция простатовезикулярного комплекса (ОШ=1,4). Необходимы дальнейшие исследования для понимания патогенеза простатита и объяснения негативного влияния простатита на мужскую фертильность.
Введение. Бесплодие – медицинская проблема, с которой сталкиваются около 15% пар в развитых странах и до 30% в странах Центральной Африки и Азии [1, 2]: в 2/3 случаев оно первичное, в 1/3 – вторичное [3]. Этиология бесплодия многофакторная – в четверти случаев бесплодие вызвано только мужским фактором и в половине случаев имеют место сочетанные нарушения одновременно у мужа и жены [4–6].
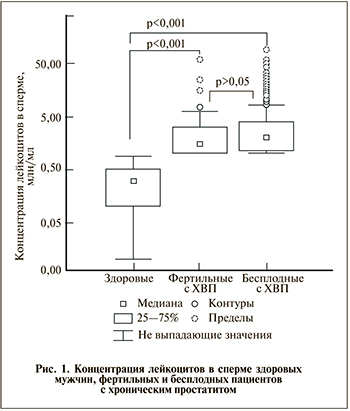 Инфекции мужских половых органов считают одной из потенциально исправимых причин снижения мужской фертильности [4, 7, 8]. От 2 до 20% случаев мужского бесплодия (до 35–70% в отдельных возрастных и этнических группах) связывают с инфекциями мужских половых путей, включая простатит [4, 9, 10]. Распространена точка зрения, согласно которой увеличение концентрации лейкоцитов в генитальном тракте и сперме сопровождается снижением концентрации доли подвижных и морфологически нормальных форм сперматозоидов [11–14]. Опубликованные данные объясняют снижение качества эякулята при хроническом простатите (ХП) следствием нарушения физико-химических свойств семенной жидкости [7, 15–17], воздействия активных форм кислорода (АФК) [18–21], прямого и опосредованного токсического действия патогенных микроорганизмов [22–24].
Инфекции мужских половых органов считают одной из потенциально исправимых причин снижения мужской фертильности [4, 7, 8]. От 2 до 20% случаев мужского бесплодия (до 35–70% в отдельных возрастных и этнических группах) связывают с инфекциями мужских половых путей, включая простатит [4, 9, 10]. Распространена точка зрения, согласно которой увеличение концентрации лейкоцитов в генитальном тракте и сперме сопровождается снижением концентрации доли подвижных и морфологически нормальных форм сперматозоидов [11–14]. Опубликованные данные объясняют снижение качества эякулята при хроническом простатите (ХП) следствием нарушения физико-химических свойств семенной жидкости [7, 15–17], воздействия активных форм кислорода (АФК) [18–21], прямого и опосредованного токсического действия патогенных микроорганизмов [22–24].
В то же время имеются работы, в которых оспаривается взаимосвязь ХП и лейкоцитоспермии, с одной стороны, и параметрами спермограммы, с другой [10, 25–28]. По мнению экспертов Европейской ассоциации урологов [5], убедительных данных за то, что ХП оказывает влияние на качество спермы и служит причиной мужского бесплодия, на сегодняшний день нет. Очевидно, снижение фертильности при ХП имеет место не всегда и зависит от массы дополнительных факторов, которые приводят к дисбалансу компенсаторно-приспособительных и дезадаптивных реакций, возникающих в процессе течения хронического заболевания.
Нами проведено исследование с целью изучения комплекса факторов, приводящих к снижению фертильности у мужчин с ХП. Настоящая статья представляет фрагмент данного исследования и посвящена роли клинико-анамнестических и микробных факторов в развитии бесплодия при ХП.
Материал и методы. Исследование носило многоцентровый комплексный клинико-лабораторный одномоментный ретроспективный характер. Проведен анализ медицинских карт и компьютерных историй болезни 3174 мужчин в возрасте от 20 до 45 лет, состоявших в гетеросексуальных брачных отношениях и живших регулярной половой жизнью.
Обследование пары и исследование спермы выполнены в соответствии с требованиями ВОЗ [4, 29]. Концентрация лейкоцитов определена путем окраски нативного эякулята на пероксидазу с помощью набора LeucoScrin® (FertiPro N.V., Бельгия) и с вычислением доли лейкоцитов среди круглых клеток, подсчитанных в счетных камерах (Маклера, Горяева), после краски азур-эозином по Романовскому (ЭКОлаб-Гем-Романовский, Россия).
Ультразвуковое исследование мошонки, простаты и семенных пузырьков проведено с применением конвексного абдоминального и ректального мультипланового датчиков по стандартным методикам на аппаратах LOGIQ-5 и -9 «GE» (США), Flex Focus-1202 «B-K Medical» (Дания). Для оценки эвакуаторной способности семенных пузырьков их УЗИ выполнено до и после эякуляции: недостаточностью опорожнения считали уменьшение размеров семенного пузырька после эякуляции менее чем на 65% от исходного.
На первом этапе исследования по данным спермограммы 3023 мужчин из бесплодных пар выделена группа пациентов (n=572) с лабораторными признаками воспалительного процесса в репродуктивном тракте в виде лейкоцитоспермии (>1 млн/мл). На втором – группа пациентов (n=164), у которых продолжительность ХП превышала таковую вынужденного бесплодия (ПВБ) и не было других установленных причин снижения фертильности (нарушения кариотипа, микроделеции AZF, крипторхизм, варикоцеле, гидроцеле, эректильная дисфункция, перенесенные операции на органах мошонки, а также снижение концентрации сперматозоидов менее 5 млн/мл независимо от этиологии), а супруги не имели очевидных причин бесплодия (нарушения овуляции, трубный фактор, инфекционно-воспалительные процессы). На третьем этапе из анализа были исключены 64 мужчины с первичным бесплодием, у которых возможной причиной снижения репродуктивной функции могли быть невыявленные генетические факторы (процесс сперматогенеза регулируют более 2000 генов). Оставшихся пациентов (n=100) мы считали вторично бесплодными вследствие ХП (БХП), что соответствовало диагнозу «инфекции придаточных половых желез» (по ВОЗ, 2000). Группу сравнения – фертильных мужчин с ХП (ФХП) составили пациенты (n=105) с диагнозом ХП более года, имевшие детей моложе года (или факт беременности у жены), с симптомами нижних мочевыводящих путей (СНМП) или с бессимптомными формами воспаления, обнаруженного при диспансеризации, не предъявлявшие жалоб на бесплодие. Восемьдесят четыре урологически здоровых фертильных волонтеров и мужчин, обследованных при плановой диспансеризации, имевших нормозооспермию и нормальное содержание лейкоцитов в сперме, составили контрольную группу здоровых фертильных му...












