Кардиология №9 / 2013
Роль дисфункции почек и мультифокального атеросклероза в оценке прогноза у больных инфарктом миокарда и подъемом сегмента ST
ФГБУ НИИ комплексных проблем сердечно-сосудистых заболеваний СО РАМН, 650002 Кемерово, Сосновый бульвар, 6; ГБОУ ВПО Кемеровская государственная медицинская академия Минздрава РФ; МБУЗ Кемеровский кардиологический диспансер
Цель исследования состояла в оценке частоты выявления и выраженности дисфункции почек (ДП), а также ее прогностического значения у больных инфарктом миокарда с подъемом сегмента ST (ИМпST) и мультифокальным атеросклерозом (МФА). В исследование включены 529 пациентов с диагнозом ИМпST. Всем больным рассчитаны клиренс креатинина (ККр) по формуле Кокрофта—Гаулта и скорость клубочковой фильтрации (СКФ) по формуле MDRD. На 5—10-е сутки госпитального периода 423 больным выполнено ультразвуковое исследование артерий нижних конечностей (АНК) и экстракраниальных артерий (ЭКА) для выявления признаков МФА. Признаки МФА констатированы у 95% больных. Госпитальная летальность составила 10,9%. Через год у 397 пациентов оценили выживаемость путем телефонного опроса. Смертельные исходы зарегистрированы у 39 (9,8%) больных. При расчете СКФ выявлено, что у 35,5% больных СКФ составила от 30 до 60 мл/мин/1,73 м2, у 4,9% — менее 30 мл/мин/1,73 м2. В то же время ККр от 30 до
60 мл/мин регистрировался у 29,5% больных, менее 30 мл/мин — у 3%. При начальном проявлении МФА (стенозы до 30%) выявлялось прогрессивное снижение средних показателей ККр и СКФ. Однако связь между МФА и ДП, оцененная по формуле Кокрофта—Гаулта, оказалась более выраженной. Наличие ДП у больных ИМпST и МФА ассоциируется с повышением госпитальной летальности и смертности в течение 1-го года наблюдения. Сделан вывод, что у больных, перенесших ИМпST, любое проявление периферического атеросклероза и нарушение функции почек следует рассматривать как независимые предикторы сердечно-сосудистых осложнений.
Сердечно-сосудистые заболевания (ССЗ) справедливо называют эпидемией ХХ и ХХI веков. В течение нескольких десятилетий они являются главной причиной смерти населения в индустриально развитых странах, в том числе в России, где от ССЗ ежегодно умирают почти 1,2 млн человек, что составляет 55,5% от общей смертности [1].
По влиянию на состояние здоровья пациента, риску фатальных состояний, трудностям диагностики, профилактики и лечения, социальному значению острый коронарный синдром (ОКС) первенствует среди кардиальной патологии [2].
Известно, что атеросклероз — это системное, мультифокальное заболевание [3, 4]. По данным исследований, распространенность периферического атеросклероза среди взрослого населения составляет от 13,5 [5] до 95% [3, 6].
Периферический атеросклероз, как и хроническая болезнь почек (ХБП), является наиболее распространенным заболеванием среди лиц старше 65 лет и одним из факторов, влияющих на развитие неблагоприятных сердечно-сосудистых исходов [7]. Результаты крупных эпидемиологических исследований (NHANES III, Okinawa Studу и др.), выполненных в последние десятилетия, показали высокую распространенность дисфункции почек (ДП) в общей популяции (10—20%) [8], что сопоставимо с распространенностью заболеваний, традиционно рассматриваемых как социально значимые — бронхиальной астмы, ишемической болезни сердца (ИБС) и др. При этом лишь около 1/4 лиц со сниженными скоростью клубочковой фильтрации (СКФ) и клиренсом креатинина (ККр) информированы о наличии у них ХБП [9].
 В ранее проведенных исследованиях показано, что у больных инфарктом миокарда (ИМ) ДП регистрируется значительно чаще, чем в общей популяции за счет ишемической нефропатии на фоне комплексного воздействия таких факторов, как снижение насосной функции миокарда, артериальная гипертензия (АГ), мультифокальный атеросклероз (МФА) и сахарный диабет (СД) 2 типа [10]. По данным регистра ADHERE, у 30% всех госпитализированных больных с острой сердечной недостаточностью (СН) имелась ХБП или концентрация креатинина в плазме крови более 2 мг/дл в анамнезе [11].
В ранее проведенных исследованиях показано, что у больных инфарктом миокарда (ИМ) ДП регистрируется значительно чаще, чем в общей популяции за счет ишемической нефропатии на фоне комплексного воздействия таких факторов, как снижение насосной функции миокарда, артериальная гипертензия (АГ), мультифокальный атеросклероз (МФА) и сахарный диабет (СД) 2 типа [10]. По данным регистра ADHERE, у 30% всех госпитализированных больных с острой сердечной недостаточностью (СН) имелась ХБП или концентрация креатинина в плазме крови более 2 мг/дл в анамнезе [11].
Как известно, стойкое снижение СКФ и наличие МФА являются независимыми предикторами повышенного риска смерти от ССЗ [3, 12]. Можно предполагать, что пациенты с ИМ с подъемом сегмента ST (ИМпST), имеющие сочетанную патологию (МФА и ХБП), составляют группу повышенного риска развития сердечно-сосудистых осложнений (ССО) по сравнению с пациентами, имеющими только одно из этих заболеваний.
Цель настоящего исследования состояла в оценке частоты выявления и выраженности ДП, а также ее прогностического значения у больных ИМпST и МФА.
Материал и методы
Исследование основано на регистре ОКС с подъемом сегмента ST, проводимого в Кемеровском кардиологическом диспансере в период с 2008 по 2009 г. В исследование были включены 529 пациентов. Критерием включения был установленный, согласно рекомендациям Всероссийского научного общества кардиологов, диагноз ИМпST давностью до 24 ч от начала заболевания [13]. Исследование было одобрено локальным этическим комитетом, все больные после ознакомления подписали форму информированного согласия. Схема обследования включала сбор жалоб, анамнеза, клинический осмотр кардиологом, запись электрокардиограммы, оценку уровня кардиоспецифических ферментов, контроль показателей системной гемодинамики, проведение эхокардиографии. Всем больным рассчитаны ККр по формуле Кокрофта—Гаулта и СКФ по формуле MDRD [12]. Помимо общепринятых общеклинических исследований 423 больным на 5—10-е сут госпитального периода проведено цветовое дуплексное сканирование (ЦДС) артерий нижних конечностей (АНК) и экстракраниальных артерий (ЭКА) при помощи линейных датчиков с частотой 5—7 МГц (для ЭКА), конвексного датчика с частотой 2,5—3 МГц и линейного — 5 МГц (для АНК). Оценку толщины интима—медиа (ТИМ) осуществляли в дистальной, средней и проксимальной точках общей сонной артерии с вычислением среднего значения, при этом нормальным считали значение менее 1 мм. Признаки МФА констатированы у 95% больных (стенозы любой степени или увеличение ТИМ). На основании данных ЦДС больные были распределены в 4 группы. В 1-ю группу вошли 22 (5,2%) пациента без МФА, во 2-ю — 201 (47,5%) с ТИМ ≥1 мм или стенозами менее 30%, в 3-ю — 75 (17,7%) больных со стенозами от 30 до 50%, в 4-ю — 125 (29,6%) больных со стенозами 50% и более. Разделение на группы осуществляли согласно модифицированной классификации атеросклеротического поражения некоронарных артерий, предложенной в работе З.А. Суслиной (2006) [14].
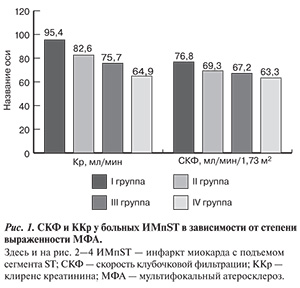 Всем пациентам в кратчайшие сроки определяли предпочтительный метод реперфузии миокарда — чрескожное коронарное вмешательство (ЧКВ) или проведение системной тромболитической терапии (ТЛТ). Рев...
Всем пациентам в кратчайшие сроки определяли предпочтительный метод реперфузии миокарда — чрескожное коронарное вмешательство (ЧКВ) или проведение системной тромболитической терапии (ТЛТ). Рев...












