Терапия №2 / 2015
Роль эндотоксина кишечной микробиоты в патогенезе атеросклероза
ГБОУ ВПО «Московский государственный медико-стоматологический университет им. А.И. Евдокимова», кафедра поликлинической терапии, г. Москва
Современные данные о процессах, лежащих в основе атерогенеза, свидетельствуют о значительной роли эндотоксина кишечной микрофлоры в развитии сосудистых поражений. В работе обобщены материалы литературы и результаты собственных исследований о путях проникновения и участии липополисахарида (эндотоксина) грамотрицательных бактерий в инициировании и прогрессировании атеросклероза. Эндотоксин может активировать все клетки, принимающие участие в формировании атеросклеротических бляшек, вызывать трансформацию макрофагов интимы артерий в пенистые клетки, индуцировать повреждения эндотелия и гиперлипидемию. Лучшее понимание механизмов образования атеросклеротических изменений может помочь в разработке новых вариантов лечения и профилактики заболевания.
В последние годы появляется все больше данных о том, что в развитии атеросклероза принимает участие желудочно-кишечный тракт (ЖКТ). Ишемия кишечника, неизбежная при выраженном атеросклеротическом поражении брыжеечных артерий, может играть значительную роль в бактериальной транслокации вследствие повышенной кишечной проницаемости. Повреждения кишечной стенки могут вести к ускоренной транслокации бактерий и/или эндотоксина. Рассматривая роль эндотоксина кишечной микрофлоры в развитии атеросклеротического процесса, необходимо вспомнить, что эндотоксин представляет собой липополисахарид (ЛПС), постоянно образующийся из внешней мембраны клеточной стенки грамотрицательных бактерий в результате самообновления клеточного пула, обладает широким спектром различных видов биологической активности и может взаимодействовать практически со всеми клетками [1–6].
В связи с выраженным токсическим действием на организм млекопитающих, ЛПС получил также название эндотоксина. В отличие от бактериальных экзотоксинов, выделяемых живой клеткой, эндотоксин выделяется во внешнюю среду, главным образом при непрерывном самообновлении бактериальных клеток. ЛПС обладает весьма широким спектром биологической активности. Попадая в организм, эндотоксин может действовать на различные клетки и вызывать целый ряд эффектов [6–8]. Исход взаимодействия с различными клетками зависит от концентрации ЛПС [4]. При попадании в кровоток физиологических доз ЛПС имеет место т.н. физиологическая системная эндотоксинемия [9], которая при увеличении концентрации эндотоксина в кровотоке проявляет агрессивные свойства, характеризующиеся очень широким спектром патогенного действия ЛПС. С увеличением дозы эндотоксин вызывает гиперактивацию клеток и систем, что может приводить к развитию диссеминированного внутрисосудистого свертывания, эндотоксинового шока и полиорганной недостаточности.
В 1952 г. O. Westphal, O. Luderitz [10] расшифровали биохимическую формулу ЛПС. Его молекула состоит из трех фрагментов: хвоста (полисахарида), ядра и липида А [11, 12]. Первые два определяют видоспецифичность эндотоксина различных грамотрицательных бактерий (за счет высокого полиморфизма сахаров), которая лежит в основе серологической идентификации различных видов и штаммов микроорганизмов. В то же время липид А характеризуется высокой консервативностью биохимической структуры, не обладает видовой специфичностью, содержит около 200 эпитопов и независимо от своего происхождения практически идентичен для всех ЛПС. Именно липид А обусловливает весь очень широкий спектр общих биологических свойств эндотоксина. В естественных условиях синтеза ЛПС генетически дефектными (по набору полимерсинтетаз) штаммами грамотрицательных бактерий самая минимальная по массе структура эндотоксина, сохраняющая жизнеспособность микроорганизма, состоит из липида А и трех остатков кетодезоксиоктулоновой кислоты. Этот дефектный ЛПС сохраняет весь спектр общих биологических свойств эндотоксина и получил название Re-гликолипида. Именно эта гидрофобная структура ответственна за весь спектр общих для ЛПС любого происхождения свойств, который может иметь как полезную, так и патогенную направленность своего биологического действия.
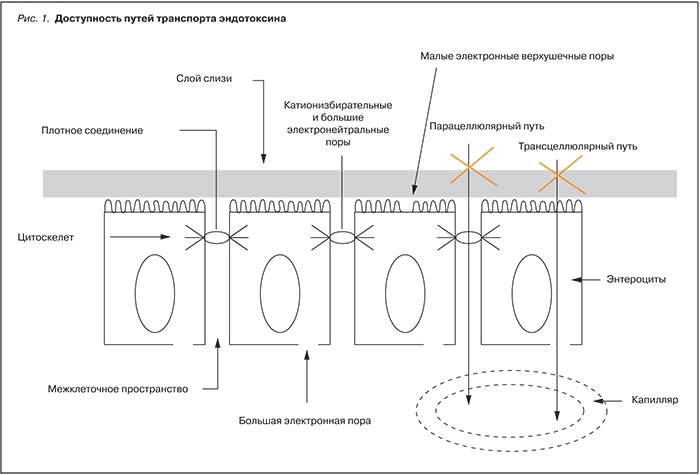
В зависимости от дозы эндотоксин вызывает повреждения клеток или стимулирует синтез ряда физиологически активных медиаторов, таких как эндогенный пироген, интерлейкины, туморнекротизирующий фактор и другие [2–5, 8, 9]. Предполагается, что эндотоксин может быть серьезным стимулом продукции цитокинов при атеросклерозе путем воздействия на мононуклеарные клетки [12, 13]. Согласно этой гипотезе, эндотоксин попадает в систему кровообращения посредством транслокации из кишечника. Различают два пути транспорта веществ в эпителии слизистой оболочки кишечника: через клетку (трансцеллюлярный) и через плотный контакт по межклеточным пространствам эпителиальных клеток (парацеллюлярный, шунтирующий) (рис. 1). Трансцеллюлярный транспорт может осуществляться посредством двух механизмов: трансмембранного переноса и эндоцитоза (пиноцитоза). Поскольку размеры молекулы эндотоксина – до 75 килодальтон, она не способна проникать в клетку парацеллюлярным путем, но и проникновение трансмембранным переносом невозможно по той же причине. Таким образом, транслокация эндотоксина через кишечный барьер возможна только путем эндоциноза. Именно эндоцитоз является тем каналом, по которому происходит перенос не только ионов и мономеров, но и большинства крупномолекулярных соединений, к коим и относится эндотоксин.
Эндоцитоз – это процесс образования эндоцитозных инвагинаций апикальной мембраны, расположенных между основаниями микроворсинок энтероцита, и транспорт крупномолекулярных веществ, попавших в эти инвагинации. При образовании пиноцитозных инвагинаций происходит локальное растяжение апикальной мембраны, затем транспорт везикулы и высвобождение ее содержимого (эндото...












