Московский уролог №1 / 2016
Роль метаболитов эстрогенов в этиопатогенезе рака предстательной железы
Несмотря на успехи, достигнутые в диагностике и лечении рака предстательной железы (РПЖ), все еще остаются многочисленные неразрешенные вопросы, касающиеся этиологии и патогенеза этого заболевания. Актуальность этой проблемы неуклонно растет параллельно с прогрессивным увеличением числа мужчин, страдающих РПЖ, на фоне увеличения продолжительности жизни. Нет четкого понимания взаимодействия половых гормонов между собой и их воздействия на те или иные рецепторы в предстательной железе, т.е. системных эндокринных и локальных паракринных эффектов, что и является основной проблемой в патогенезе РПЖ и нахождения эффективных методов его лечения.
Не секрет, что подавляющее большинство исследователей и практикующих врачей до сих пор считают основными виновниками развития РПЖ исключительно базовые андрогены – тестостерон и дигидротестостерон. Более того, одним из основных методов лечения на сегодняшний день является антиандрогенная терапия, эффективность которой не всегда оправдывает ожидания врача и пациента, не говоря уже о серьезном ухудшении качества жизни больных!
Так же, как и все гормоны, эстрогены имеют системное и локальное воздействие на мужской организм. Именно метаболитам эстрогенов все больше исследователей отводят ключевую роль в реализации механизмов развития онкогенных процессов в предстательной железе (ПЖ).
Изначально в мужском организме из андрогенов под воздействием фермента ароматазы вырабатываются эстрогены, преимущественно в жировой ткани, и в т.ч. в стромальной части ПЖ. Затем, попадая в кровоток, эстрогены связываются с глобулином, связывающим половые стероиды.
Эта часть общего пула эстрогенов становится их стратегическим запасом. Только небольшая часть эстрогенов остается в свободном, несвязанном состоянии, составляя их биологически активный компонент.
Эстрогены отличаются от андрогенов еще и тем, что на сегодняшний день известен не один, а как минимум два вида эстрогеновых рецепторов – Еα и Еβ, с разнонаправленным действием. Так, стимуляция Еα-рецепторов способствует развитию воспаления и неопластических процессов в ПЖ, тогда как стимуляция Еβ-рецепторов оказывает прямо противоположное онкопротекторное действие. Эстрогены, как и все стероидные гормоны, являются липофильными соединениями, поэтому могут элиминироваться из организма только после перевода их в водорастворимую форму при участии ряда ферментов I и II фаз детоксикации в печени.
В I фазе этого процесса жирорастворимые эстрогены (эстрадиол и эстрон) под действием ферментов группы цитохрома Р450 подвергаются трансформации с образованием промежуточных водорастворимых продуктов. В зависимости от того, какой из цитохромов Р450 – 1А2, 3А4 или 1В1 будет воздействовать на субстрат, будут соответственно образовываться различные производные – 2(ОН)Е1/2, 16(ОН)Е1/Е2 или 4(ОН)Е1/Е2 гидроксиэстрогены (рис. 1).
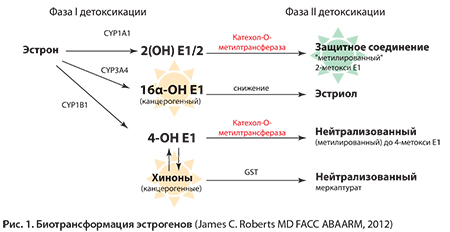
При этом интерес в плане метаболических эффектов эстрогенов представляет как соотношение между ними, так и соотношение между их гидроксилированными метаболитами 2(ОН)Е1/2 и 4(ОН)Е1/Е2, а также и последующими третичными метоксилированными производными – 2(Ме)Е1/2 и 4(Ме)Е1/Е2.
Это обусловлено тем, что указанные метаболиты эстрогенов существенно различаются своими метаболическими эффектами.
В очень упрощенном виде можно сказать, что 2-гидроксилированные и 2-метоксилированные производные обладают значительным онкопротекторным действием, в то время как 4- и 16-гидроксилированные производные, напротив, имеют выраженные митогенный и мутагенный потенциалы и являются серьезными канцерогенами.
На практике наиболее ценным оказывается определение соотношения между 2- и 16-гидроксиэстрогенами, поскольку оно является более чувствительным маркером канцерогенеза. 2-гидроксиэстрогены обладают невысоким (около 50% активности эстрадиола) уровнем пролиферативного влияния на клетки эндометрия, молочной железы и ПЖ (рис. 2).












