Акушерство и Гинекология №5 / 2025
Роль перегрузки железом в развитии гестационного сахарного диабета и других метаболических нарушений во время беременности
ФГБОУ ВО «Сибирский государственный медицинский университет» Министерства здравоохранения Российской Федерации, Томск, Россия
Роль железа в развитии нарушений углеводного обмена известна достаточно давно. Первые наблюдения опирались на повышенный риск развития сахарного диабета у пациентов, страдающих наследственными нарушениями обмена железа с повышенным отложением его в печени и поджелудочной железе при гемохроматозе. В дальнейшем нарушения углеводного обмена при беременности (гестационный сахарный диабет) связывались в основном с возросшей инсулинорезистетностью, нарушенной секрецией инсулина у генетически предрасположенных лиц, с ожирением и метаболическим синдромом у женщин до периода гестации. Однако все большее количество доказательств получает гипотеза о роли перегрузки железом, связанной с метаболическим синдромом, метаболически ассоциированной с жировой болезнью печени, с индукцией и прогрессированием нарушений углеводного обмена. В статье приводятся современные данные об ассоциации нарушений обмена железа с риском развития гестационного сахарного диабета, подробно рассматриваются механизмы влияния феррокинетики на формирование глюкозной интолерантности, а также отдельно обсуждается вопрос роли пищевых добавок железа в развитии гестационного сахарного диабета. Авторы обзора ссылаются на действующие клинические рекомендации и алгоритмы оказания медицинской помощи, принятые в Российской Федерации и за рубежом, а также на данные отдельных наиболее современных исследований по заявленной проблеме.
Заключение: Обмен железа у беременных женщин является сложно регулируемым процессом, но имеет отношение к уже имеющимся до беременности метаболическим рискам или к рискам, которые возникают во время беременности. Перегрузка железом может стать одним из механизмов, повышающих риск развития гестационного сахарного диабета и это необходимо учитывать, разрабатывая индивидуальный алгоритм наблюдения за беременной женщиной.
Вклад авторов: Саприна Т.В., Мусина Н.Н. – концепция и дизайн исследования, редактирование; Саприна Т.В., Мусина Н.Н., Пушкарева Е.С. – сбор и обработка материала, написание текста. Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Конфликт интересов: Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Финансирование: Работа выполнена по инициативе авторов без привлечения финансирования.
Для цитирования: Саприна Т.В., Мусина Н.Н., Пушкарева Е.С.
Роль перегрузки железом в развитии гестационного сахарного диабета и
других метаболических нарушений во время беременности.
Акушерство и гинекология. 2025; 5: 5-12
https://dx.doi.org/10.18565/aig.2024.331
Одно из первых описаний инсулинорезистентности (ИР) было сделано в 1929 г. H.F. Root в контексте «бронзового диабета», известного как гемохроматоз, который характеризуется нарушением обмена железа [1]. С тех пор было множество гипотез о том, что нарушения метаболизма железа являются частью метаболического синдрома, который ассоциируется с ИР, гиперинсулинемией, гипергликемией, дислипидемией и центральным ожирением. К примеру, метаанализ Kataria Y. et al. показал, что биомаркеры эндогенного железа сыворотки крови (ферритин, гемоглобин, насыщение трансферрина железом) были выше у женщин с гестационным сахарным диабетом (ГСД), а в ходе анкетирования потребления экзогенного железа (общее количество пищевого железа, без учета дополнительных добавок, негемовое и гемовое железо, пищевые добавки железа) была определена связь между риском развития ГСД и потреблением гемового железа [2].
Гомеостаз железа и факторы, которые на него влияют
Успешный транспорт железа – это сложный биомеханизм, в котором участвует множество различных скоординированных белков. Трансферрин (Tf) – белок, связывающийся с трехвалентным железом. На клеточном уровне усвоение железа путем эндоцитоза поддерживается за счет рецептора трансферрина-1 (TfR-1). Растворимые рецепторы трансферрина (sTfR) образуются в результате расщепления TfR-1 из плазматической мембраны во время созревания эритроида. Количество sTfR отражает количество молодых эритроцитов и их степень насыщения железом, поскольку концентрация TfR-1 регулируется уровнем внутриклеточного железа [3]. После эндоцитоза Fe3+ восстанавливается в эндосомах до Fe2+ металлоредуктазой (STEAP3). Затем двухвалентное железо транспортируется во внутриклеточный пул железа с помощью транспортера двухвалентного металла 1 (DMT1). Если железо в данный момент не требуется для метаболических реакций, оно соединяется с ферритином, создавая, таким образом, внутриклеточное депо, что имеет решающее значение для удержания этого металла в нетоксичной форме. В другом случае железо будет экспортироваться в плазму с помощью ферропортина (FPN) – единственного мембранного экспортера железа, который служит «предохранителем» в случае внутриклеточной перегрузки железом. Такой контроль осуществляется с помощью гепсидина [1]. Гепсидин – это пептидный гормон, который в основном экспрессируется печенью, однако может локально синтезироваться другими тканями, включая почки, поджелудочную железу, жировую ткань, макрофаги, сердце и мозг [4]. Он высвобождается в ответ на повышение насыщения трансферрина железом, увеличение запасов железа в печени или воспаление, вызывая деградацию FPN, тем самым снижая абсорбцию металла энтероцитами и ингибируя его высвобождение из макрофагов и печеночного депо [1]. Снижение синтеза гепсидина происходит при дефиците железа и повышении эндогенного эритропоэтина для поддержания эритропоэза [3]. Эритропоэтин – это гормон, выделяемый почками в ответ на относительную гипоксию, который воздействует на костный мозг, стимулируя выработку эритроцитов [1].
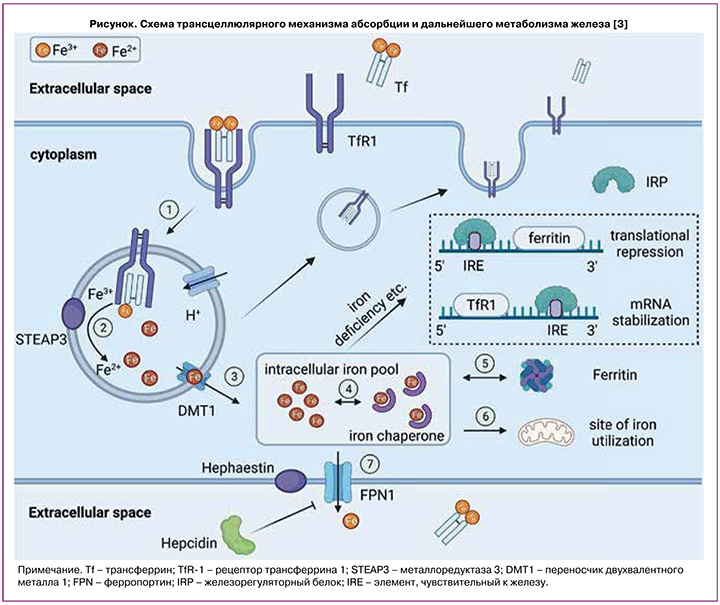
Механизм транспорта железа
Механизм транспорта железа представлен на рисунке. Fe3+, связанное с Tf, взаимодействует с TfR-1. Комплекс Tf–TfR-1 усваивается посредством рецептор-опосредованного эндоцитоза (1). В эндосоме Fe3+ восстанавливается до Fe2+ металлоредуктазой STEAP3 (2). Fe2+ транспортируется во внутриклеточный пул железа с помощью транспортера DMT1 (3). В цитоплазме существуют шапероны железа, которые перемещают железо внутри клетки (4). Внутриклеточное железо может быть изолировано ферритином (5) или доставляться к месту необходимости (6). Для осуществления метаболических процессов железо экспортируется в плазму с помощью FPN (7). Регулировка уровня железа в крови происходит посредством гепсидина, который блокирует его поступление из клеток путем деградации FPN. Внутриклеточный уровень железа регулируется комплексом IRP-IRE. При его низкой концентрации IRP блокирует трансляцию ферритина и ингибирует деградацию TfR-1, воздействуя на мРНК.
Связь обмена железа с углеводной интолерантностью
Одним из возможных объяснений взаимосвязи железа и развития метаболических нарушений является токсичность его свободной формы, которая запускает каскад окислительно-восстановительных реакций, активирующих повреждение тканей организма. Данный механизм называется ферроптозом, это вид запрограммированной гибели клеток, характеризующийся накоплением железа и повреждением клеточных мембран, вызванным перекисным окислением липидов (ПОЛ). Zhang Y. et al. отмечают, что к наиболее распространенным липидам, инициирующим ферроптоз, относятся полиненасыщенные жирные кислоты (ПНЖК), токсичные гидроперекиси которых образуются в результате окисления неферментативным или ферментативно-опосредованными путями [3]. Неферментативное окисление фосфолипидов – это железозависимое окисление липидов. Гидроксильные радикалы, образующиеся при вз...












