Кардиология №12 / 2012
Роль трансформирующего β-фактора роста в патогенезе пролапса митрального клапана
ФГБУ Федеральный центр сердца, крови и эндокринологии им. В.А. Алмазова МЗСР РФ, 197341 Санкт-Петербург, ул. Аккуратова, 2
Изменения активности различных компонентов сигнального пути β-фактора роста (TGF-β) связаны с целым рядом наследственных нарушений развития соединительной ткани, таких как синдром Марфана, синдром Льюиса—Дитца и др. Однако его влияние на формирование пролапса митрального клапана (МК) изучено мало. Обследованы 35 пациентов (средний возраст 62,5±7,9 года, 46% мужчины). Повышение концентрации TGF-β1/2 выявлено в 65% случаев. Степень повышения концентрации TGF-β1/2 коррелировала с толщиной задней створки МК (r=0,67; p=0,016), резидуальным прогибом створок МК (r=0,68; p=0,007) и степенью резидуальной митральной регургитации (r=0,56; p=0,01). У пациентов с высоким содержанием TGF-β1/2 в сыворотке крови наблюдалось достоверное снижение продольной систолической (–13,5±2,2% против –16,6±2,3%, р=0,008) и диастолической (1,14±0,20 c–1 против 1,34±0,18 c–1, р=0,04) деформации и СД (–0,89±0,15 c–1 против –1,14±0,15 c–1, р=0,002) миокарда по сравнению с таковыми у пациентов с нормальным содержанием TGF-β1/2. Таким образом, TGF-β оказывает существенное влияние на прогрессирование миксоматозных изменений МК. Высокая активность сигнального пути TGF-β сочетается со снижением сократительной способности левого желудочка, что обусловлено, вероятно, его профибротической активностью.
Семейство трансформирующего β-фактора роста (TGF-β) включает группу гомологичных гетеродимерных белков TGF-β1, -β2 и -β3, которые были так исходно названы по их способности активировать рост фибробластов, стимулируя трансформацию клеток [1]. Эти белки экспрессируются в миофибробластах, гладких мышечных клетках сосудов, эндотелиальных клетках и макрофагах. Влияние TGF-β на клетку обеспечивается благодаря сигнальному пути TGF-β, включающему специфичные мембранные рецепторы и внутриклеточные медиаторы и регулирующему множество биологических процессов, в том числе морфогенез, эмбриональное развитие, дифференцировку стволовых клеток, иммунный ответ, воспаление, а также формирование и деградацию экстрацеллюлярного матрикса (ЭЦМ). Рецепторами к TGF-β являются мембранные серин-/треонинкиназы I и II типов (TBRI и TBRII соответственно), а внутриклеточный этап сигнального пути TGF-β подразделяется на классический и альтернативный. Классический путь включает активирование белков Smad2 и Smad3, их гетеромеризацию с участием кооперирующего Smad4 и проникновение гетеромерного комплекса внутрь ядра, где они выполняют функцию активатора транскрипции генов, ответственных за формирование и деградацию ЭЦМ (табл. 1) [2, 3]. Однако TGF-β стимулирует деградацию ЭЦМ в первую очередь через не-Smad альтернативные пути, что приводит к повышенной экспрессии генов матричных металлопротеиназ (ММП), активатора плазминогена и др., вызывая протеолитическую деструкцию ЭЦМ (см. рисунок) [4—6]. Наличие многих уровней и различных механизмов регулирования формирования и деградации ЭЦМ делают сигнальный путь TGF-β (классический и альтернативные) ключевым звеном, влияющим на его строение.
Таблица 1. Влияние классического сигнального пути TGF-βна формирование ЭЦМ [6]
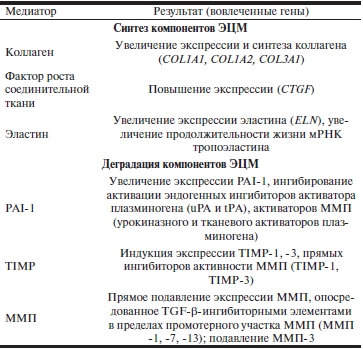
Примечание. TGF-β — трансформирующий β-фактор роста; ЭЦМ — экстрацеллюлярный матрикс; PAI-1 — ингибитор активатора плазминогена-1; TIMP — тканевый ингибитор металлопротеиназ; ММП — матричные металлопротеиназы.
Изменение активности различных компонентов сигнального пути TGF-β связано с целым рядом наследственных нарушений соединительной ткани. При синдроме Марфана из-за нарушения функции фибриллина, обусловленного различными мутациями гена FBN-1, нарушается секвестрация латентного комплекса TGF-β, что делает его более доступным для активации и ведет к повышению его концентрации. Считается, что целый ряд проявлений синдрома Марфана, в частности аневризма аорты, обусловлены именно повышением активности сигнального пути TGF-β [7]. Синдром Льюиса—Дитца 1-го и 2-го типа, выделенный недавно из синдрома Марфана, вызван мутациями в обеих субъединицах рецептора к TGF-β (TBR1 и TBR2 соответственно). И хотя мутантные рецепторы TGF-β не в состоянии передавать сигналы внутрь клетки, неизмененные рецепторы (они также экспрессируются у гетерозиготных пациентов) чрезмерно активно реагируют на TGF-β, что фактически выражается в повышенной активности сигнального пути TGF-β [8]. Миксоматозные изменения в митральном клапане (МК), приводящие к его недостаточности, при этом наблюдаются преимущественно при мутации гена FBN-1, но не TBR2 [9]. Повышение концентрации TGF-β также наблюдается при сосудистом типе синдрома Элерса—Данло, что может быть обусловлено попыткой компенсировать отсутствие коллагена III типа у этих пациентов [6].
Влияние сигнального пути TGF-β на формирование пролапса МК (ПМК) изучено мало. Имеются данные о его активности в миксоматозно измененных створках при синдроме Марфана, на FBN-1C1039G/+ и FBN-1C1039G/C1039G мутантных мышах [10]. Сходные данные получены при исследовании активности внутриклеточного сигнального пути TGF-β в створках МК, участки которых были резецированы в ходе реконструктивной операции при первичном ПМК. По данным S. Rizzo и соавт., при исследовании 15 миксоматозных МК выявлены высокая плотность окрашивания ядра по фосфорилированной активной форме Smad2 (38% по сравнению с контролем — 12%; p<0,0001) и нарушенная экспрессия TGF-β-связанных генов (по данным полимеразной цепной реакции) в миофибробластах, что свидетельствует о повышенной активации сигнального пути TGF-β в клетках миксоматозно измененных створок [11]. В миксоматозных створках, по данным K. Obayashi и соавт., выявляется также повышенная экспрессия TGF-β3 и TВR-II [12]. Кроме того, изменения МК могут наблюдаться и при нарушении функционирования внутриклеточных медиаторов сигнального пути TGF-β. По данным K.M. Glavin и соавт,. у мышей с недостатком ингибиторного Smad6 наблюдается гиперплазия МК [13]. В то же время в исследовании H.T. Chou и соавт. не выявлено связи между ПМК и полиморфизмом гена TGF-β1 (C-509T и T869C) в китайской популяции [14].
В отечественной литературе также имеется ряд указаний на повышение концентрации TGF-β в сыворотке крови при ПМК. Так, в работе А.В. Ягода и соавт. показа...












