Фарматека №9 (282) / 2014
Сартаны в практике врача первичного звена при лечении артериальной гипертонии
ГБОУ ВПО «Первый МГМУ им. И.М. Сеченова» Минздрава России, Москва
В статье представлена история изучения ренин-ангиотензин-альдостероновой системы (РААС) и ее роли в сердечно-сосудистом континууме. Подробно рассмотрены этапы синтеза основного медиатора – ангиотензинаII – и структура РААС с подробным описанием функций рецепторов ангиотензина. Обсуждены возможные места блокады активности РААС с помощью блокады рецепторов ангиотензина сартанов. Подробно разобраны механизмы блокады рецепторов ангиотензина – РАТ1и их клиническая значимость при лечении сердечно-сосудистых заболеваний. Дана сравнительная характеристика двух поколений блокаторов рецепторов ангиотензина.Представлены данные литературы о клинической значимости и плейотропных эффектах телмисартана – бифункционального сартана второго поколения в лечении сердечно-сосудистых заболеваний.
Современные достижения в области кардиологии на клеточно-молекулярном уровне позволили подвергнуть критическому переосмыслению ранее считавшиеся основополагающими позиции в вопросах патофизиологии и лечения сердечно-сосудистых заболеваний (ССЗ), в частности артериальной гипертензии (АГ). Окончательно признана полигенность эссенциальной АГ, что означает необходимость ее рассмотрения не как болезнь хронически повышенного артериального давления (АД), а как сложный комплекс взаимосвязанных гемодинамических, метаболических и нейрогуморальных нарушений.
Согласно единому сердечно-сосудистому почечному континууму, предложенному в 1991 г. V. Dzau и E. Braunwald, в котором ренин-ангиотензин-альдостероновая система (РААС) представлена ведущим звеном в адаптационной регуляции параметров центральной гемодинамики, АГ следует рассматривать как один из основных модифицируемых факторов риска в прогрессировании ишемической болезни сердца (ИБС) и хронической сердечной недостаточности (ХСН) [1, 14].
Изменения во взглядах ведущих специалистов в области кардиологии на патофизиологию, диагностику и лечение АГ, произошедшие за последние десятилетия клинической практики, отражены в Европейских рекомендациях по диагностике и лечению АГ (2010–2013), в которых постулировано главное направление лечебных мероприятий – необходимость коррекции эндотелиальной дисфункции, т.к., по мнению многих ведущих специалистов, АГ – «болезнь эндотелия» [4, 7, 9, 17].
Дисфункция эндотелия – снижение способности эндотелиальных клеток секретировать эндотелий-зависимый фактор релаксации – NO, с относительным или абсолютным увеличением секреции сосудосуживающих, агрегационных и пролиферативных факторов. Одним из важных компонентов в формировании эндотелиальной дисфункции является повышенная активация РААС. Взаимосвязь изменений функции и структуры нескольких органов и систем организма в рамках сердечно-сосудистого континуума предполагает наличие общих патофизиологических процессов в развитии и прогрессировании органных повреждений. В основном все многообразие механизмов адаптации и дезадаптации может быть сведено к генетическим, нейрогуморальным и гемодинамическим факторами. Среди них одно из центральных звеньев принадлежит активации РААС, которая прослеживается практически на всех этапах сердечно-сосудистого континуума [1, 2, 3, 6, 9, 17].
Артериальная гипертензия занимает ведущее место в структуре ССЗ и их осложнений во всех странах с развитой экономикой, что определяет ее как социально-медицинскую интернациональную проблему. Стабильно высокий уровень АД > 140/90 мм рт. ст. в 3–4 раза увеличивает риск развития сердечно-сосудистых осложнений: мозговой инсульт, острый коронарный синдром, инфаркт миокарда, сердечная недостаточность с летальным исходом.
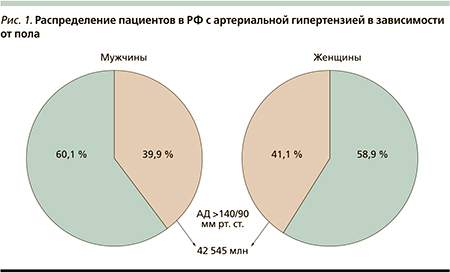
По данным эпидемиологического исследования, проведенного в РФ среди взрослого населения, у 42,5 млн человек регистрируются повышенные цифры АД: у 41,1 % женщин и 39,2 % мужчин (рис. 1).
Метаболический синдром, по определению экспертов ВОЗ: «…неинфекционная пандемия начала XXI в.». Метаболический синдром представляет собой комплекс метаболических нарушений и ССЗ (АГ, ИБС, ХСН), последовательность развития которых патогенетически взаимосвязана с инсулинорезистентностью и манифестирует нарушениями углеводного обмена, атерогенной дислипидемией, повышением триглициридов, липопротеидов низкой плотности, снижением липопротеидов высокой плотности на фоне висцерально-абдоминального типа ожирения [8, 11, 12].
Ломка старых стереотипов о концепции патогенеза хронически высокого уровня АД (взамен концепции о приоритетности гемодинамической разгрузки – снижение АД) определила главное направление лечебных мероприятий – необходимость коррекции эндотелиальной дисфункции, т.к., по мнению ведущих экспертов ВОЗ, патологически высокий уровень АД (> 140/90 мм рт. ст.), как указывалось выше, представляет собой «болезнь эндотелия» [1, 3, 4, 9, 17].
В настоящее время в Европейские рекомендации по диагностике и лечению АГ внесен ряд существенных дополнений:
Выделена «абдоминальная» (андрогенная) форма ожирения как маркера «метаболического синдрома», одним из компонентов которого является АГ.
Выделены нарушения углеводного обмена в качестве одних из ведущих факторов риска, увеличивающих частоту формирования высокого уровня АД.
К числу маркеров риска поражения эндотелия (основного звена в патогенезе АГ) добавлен С-реактивный белок, высокий уровень которого является значимым предиктором сердечно-сосудистых осложнений.
Наличие микроальбуминурии рассматривается в качестве признака поражения «органов-мишеней» при АГ (в частности, почек), в то время как протеинурия – в качестве признака ассоциированной патологии почек.
Повышение уровня креатинина в пределах 107–133 ммоль/л...












