Кардиология №3 / 2014
Сердечно-сосудистые заболевания и маннозосвязывающий лектин
Институт клинической кардиологии им. А.Л. Мясникова ФГБУ Российский кардиологический научно-производственный комплекс Минздрава РФ, 121552 Москва, ул. 3-я Черепковская, 15а
Роль врожденных факторов иммунитета в патогенезе острого коронарного синдрома (ОКС) недостаточно изучена, хотя в литературе имеются данные об их влиянии на течение сердечно-сосудистых заболеваний. Маннозосвязывающий лектин (MBL) — один из ключевых факторов гуморального врожденного иммунитета, который запускает один из путей активации комплемента. Данные литературы свидетельствуют о том, что MBL может в разных клинических ситуациях либо улучшать прогноз больных, либо быть фактором риска осложнений. Потенциально MBL может иметь отношение ко всем основным звеньям патогенеза ишемической болезни сердца (ИБС) и инфаркта миокарда: воспаление, тромбообразование, апоптоз и т.д. На разных этапах атерогенеза, включая формирование и дестабилизацию атеросклеротической бляшки, тромбоз, MBL может оказывать существенное влияние. В данном обзоре проведен анализ литературы о влиянии MBL на течение атеросклероза, ИБС и ОКС. Кроме того, приводятся данные о роли MBL в физиологических реакциях врожденного иммунитета и патогенезе различных заболеваний, строении гена MBL2 и возможных мутациях, приводящих к дефициту MBL в крови.
Морфологическим субстратом острого коронарного синдрома (ОКС) в большинстве случаев является внутрикоронарный тромб, формирующийся в результате повреждения атеросклеротической бляшки (АСБ). Согласно результатам многочисленных исследований, выполненных в последние годы, дестабилизация АСБ в значительной степени связана с воспалительными процессами. Подтверждением этого служит обнаружение в нестабильных АСБ моноцитов, макрофагов, дендритных клеток и активированных Т-лимфоцитов, приводящих к повреждению эндотелия и внутрисосудистому тромбообразованию. Как следствие у больных с ОКС в периферической крови обнаруживаются признаки системной воспалительной реакции — повышение уровня С-реактивного белка (СРБ), интерлейкинов и других маркеров. В литературе опубликованы результаты целого ряда исследований, в которых выявлена четкая связь повышенного уровня маркеров воспаления и риска развития неблагоприятных осложнений у пациентов с ОКС [1, 2].
В последнее время внимание исследователей привлекает изучение роли иммунной системы в развитии атеросклероза. Это связано, главным образом, с тем, что иммунные процессы являются триггером воспалительных реакций. Показано, что мутации гена, ответственного за синтез белка клеточной поверхности, активирующего иммунные клетки, приводит к увеличению риска развития атеросклероза и ишемической болезни сердца (ИБС) [3]. Данные экспериментальных работ указывают на важную роль иммунной системы в атерогенезе [4].
Все большее внимание привлекает изучение участия факторов врожденного иммунитета в патогенезе ОКС: речь идет о моноцитарно-макрофагальной системе, системе комплемента, активности фагоцитоза.
Более 40 лет изучается роль активации комплемента в развитии реперфузионного повреждения миокарда у больных с ОКС. В 1970 г. J. Hill и Р. Ward опубликовали данные исследования, в котором продемонстрировано, что при развитии экспериментального инфаркта миокарда (ИМ) ингибирование комплемента приводило к уменьшению хемотаксиса и аккумуляции нейтрофилов в зоне повреждения [5]. Комплемент является одним из участников воспалительной реакции [6]. Ингибирование комплемента представлялось перспективным и обоснованным патогенетическим лечением больных с ИМ. В отдельных небольших исследованиях ингибирование компонентов комплемента приводило к уменьшению размеров ИМ [7]. Однако 3 крупных рандомизированных исследования (COMMA, COMPLY, APEX-AMI) по изучению влияния ингибитора компонента С5 комплемента пекселизумаба на течение и прогноз у больных с ОКС не выявили преимуществ этого препарата [8—10].
В последнее время внимание исследователей привлекает один из факторов активации комплемента — маннозосвязывающий лектин (mannose-binding lectin, MBL).
 MBL относится к классу Са2+-зависимых (типа С) коллектинов, которые являются рецепторами опознавания антигена в системе врожденного иммунитета. Коллектины — семейство гликопротеинов, представляющих собой поливалентные полимерные комплексы, обладающие сродством к углеводам микробов. Коллектины распознают широкий спектр инфекционных агентов. К семейству коллектинов относят MBL, компонент комплемента С1q и сурфактантные протеины легких (SP-A и SP-D). В молекуле коллектинов различают коллагеновую часть и концевой лектиновый домен. С помощью коллагеновой области они связываются с белками крови или рецепторами фагоцитов (сС1qR, кальретикулин), а с помощью лектиновых доменов — с определенными углеводами поверхности микробной клетки (грамотрицательных бактерий, микобактерий), грибов, дрожжей, некоторых паразитов и вирусов, содержащих остатки маннозы, фруктозы и N-ацетилглюкозаминогликаны. Связав микробы, коллектины способствуют их поглощению фагоцитами. Другой важной функцией коллектинов является активация системы комплемента [11].
MBL относится к классу Са2+-зависимых (типа С) коллектинов, которые являются рецепторами опознавания антигена в системе врожденного иммунитета. Коллектины — семейство гликопротеинов, представляющих собой поливалентные полимерные комплексы, обладающие сродством к углеводам микробов. Коллектины распознают широкий спектр инфекционных агентов. К семейству коллектинов относят MBL, компонент комплемента С1q и сурфактантные протеины легких (SP-A и SP-D). В молекуле коллектинов различают коллагеновую часть и концевой лектиновый домен. С помощью коллагеновой области они связываются с белками крови или рецепторами фагоцитов (сС1qR, кальретикулин), а с помощью лектиновых доменов — с определенными углеводами поверхности микробной клетки (грамотрицательных бактерий, микобактерий), грибов, дрожжей, некоторых паразитов и вирусов, содержащих остатки маннозы, фруктозы и N-ацетилглюкозаминогликаны. Связав микробы, коллектины способствуют их поглощению фагоцитами. Другой важной функцией коллектинов является активация системы комплемента [11].
MBL — белок острой фазы воспаления, синтезируемый печенью под воздействием цитокинов воспаления. Структурно и функционально MBL подобен компоненту С1q комплемента. MBL — гликопротеин, состоящий из 228 аминокислот, в котором можно выделить N-концевой домен, коллагеноподобный гликозилированный домен, образующий длинный соединительный участок, короткий шеечный домен, представленный спиралью, и С-концевой домен, взаимодействующий с углеводом на мембране микроорганизма. Три пептидные цепи, образующие базовую субъединицу, в свою очередь, составляют четвертичную структуру белка MBL — олигомер, состоящий из 26 базовых субъединиц [12]. Молекулярная масса белка составляет 400—700 кД, молекулярная масса каждой пептидной цепи — 30 кД.
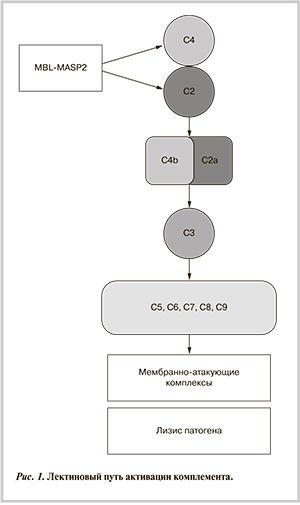
В 1987 г. доказана роль MBL в антителонезависимой активации комплемента [13]. MBL образует комплекс со специфичными сериновыми протеазами (MASP-1, 2, 3), из которых только MASP-2 обладает ферментативной активностью в отношении компонентов комплемента С2 и С4.
Активация лектинового пути комплемента происходит только при условии, что MBL, образовав комплекс с сериновой протеазой MASP-2, связывается со структурой, содержащей маннозу или N-ацетилглюкозоамин, например, с клеточной стенкой бактерий. Комплекс MB...












