Клиническая Нефрология №2 / 2016
Синхронный рак реципиента почечного трансплантата
ГБУЗ МО «Московский областной научно-исследовательский клинический институт им. М.Ф. Владимирского», Москва
В статье описан случай развития двух гистогинетически различных ракового поражения органов у больного после трансплантации почки. Обсуждаются частота, сроки развития, клинические и гистологические особенности,
а также способы лечения опухолей трансплантированной почки.
В настоящее время длительное время выживания трансплантата связано с постоянным совершенствованием хирургической техники, анестезиологического пособия, интенсивной терапии и современных эффективных иммуносупрессоров. Однако прекрасные долгосрочные результаты трансплантации сводятся на нет из-за возникающих осложнений, особенно при развитии рака. Заболеваемость, агрессивность, прогноз при возникновении рака значительно хуже, чем в общей популяции [1].
Длительно проводимая иммуносупрессия приводит к онкологическим заболеваниям от 6 до 20% реципиентов почечных трансплантатов и является одной из наиболее частых причин смерти этой категории больных [2, 3]. С увеличением времени нахождения больных на гемодиализе и сроков, прошедших после трансплантации почки, частота злокачественных образований возрастает. Детальный анализ развития рака после трансплантации почки позволил выявить следующую закономерность: риск развития рака в 35 раз выше, чем в общей популяции, преимущественно за счет ретикулоклеточной саркомы [4]. Риск возникновения лимфом в 30–40 раз выше, чем в норме и остается таким в течение последующих пяти лет. Рак кожи и губы возникает в 4 раза чаще, чем в норме, и риск его появления увеличивается с возрастанием трансплантационного интервала [5]. Частота развития опухолей к 30 годам после операции пересадки почки увеличивается от 33 до 75%. Рецидивы онкологических заболеваний после трансплантации почки наблюдались у 181 (22%) из 823 больных с предшествовавшей онкологической патологией [2]. Иммунодепрессанты, такие как циклоспорин (ЦсА) и такролимус (програф), применяемые в отношении трансплантированных пациентов, могут вызывать иммунные дефекты, таким образом ставят под угрозу иммунную реакцию и содействуют развитию вторичного иммунодефицита, который в конечном итоге может облегчить развитие онкологических заболеваний [6]. Однако данные различных авторов по этому вопросу противоречивы. Так, некоторые исследователи считают, что применение ЦсА и такролимуса не повышает риска развития новообразований по сравнению с традиционной трехкомпонентной иммуносупрессией [7].
Было показано, что распространенность рака после 10 лет функционирующего трансплантата составляет 20–30%, а через 20 лет – 45% [8, 9]. Некоторые иммунодепрессанты (ингибиторы кальциневрина, азатиоприн, тимоглобулин) оказывают непосредственное влияние на онкогенез. Ингибиторы кальциневрина способствуют опухолевому росту и метастазированию путем ингибирования репарации ДНК и усиления апоптоза. Также стимулируется производство трансформирующего фактора роста-бета (TGF-бета) и фактора роста эндотелия сосудов (VEGF). Азатиоприн и его производные способны увеличивать повреждение ДНК и ингибировать восстановление ДНК. Thymoglobulin способствовует генетическим мутациям, вызванным онковирусом. При этом стоит отметить, что некоторые виды опухолей могут показать регресс, если иммуносупрессивная терапия отменяется или изменяется на такие препараты, как ингибиторы м-TOR и микофенолаты [8, 10]. Учитывая онкологическую настороженность у больных после трансплантации, потенциальную пользу могут приносить использование иммуносупрессивных лекарств с минимальным онкогенным потенциалом и противоопухолевым эффектом. Использование ингибиторов пролиферативного сигнала m-TOR (mammalian target of rapamycin) вместо ингибиторов кальциневрина способно снижать риск рака среди трансплантированных больных [11]. Ингибиторы m-ТОR показали прямой противоопухолевый эффект. А уменьшение рака при назначении микофенолатов связывается с уменьшением дозировок ингибиторов кальциневрина. В настоящее время при выявлении рака или онкологической настороженности, плохом онкологическом анамнезе (билатеральный рак нативных почек, трансплантация донорской почки пораженной опухолью) применяется препарат m-TOR сертикан (эверолимус) [12–15].
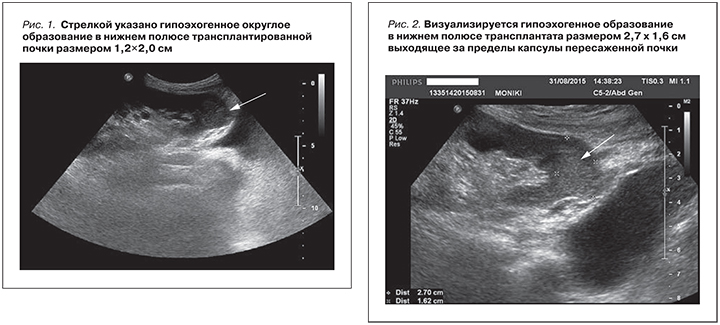
Возникновение опухоли в трансплантированной почке – довольно редкое явление. Первый случай возникновения de-novo опухоли в пересаженной почке был описан в 1988 г. [16]. Частота развития опухолей в трансплантате, по данным разных авторов, составляет от 0,1 до 0,9% [17, 18]. Большинство этих новообразований представляли собой папиллярно-клеточную карциному (55,7%), имели невысокую стадию и низкую степень злокачественности, средний размер опухоли составлял 27,8 мм. В то же время у 2 пациенток документированы случаи возникновения в трансплантатах переходно-клеточного рака высокой степени злокачественности – через 24 и 14 месяцев после ТП [19].
J.E. Belzer [20] полагает, что опухоль у трансплантированных больных под влиянием иммуносупрессии может возникать тремя путями:
- возникновение опухоли в пересаженной почке;
- перенос раковых клеток самой пересаженной почкой;
- возникновение новообразований из метастазов.
I. Penn считает, что опухоли ренального трансплантата, диагностированные...












