Кардиология №9 / 2014
Систематический анализ магнийзависимых митохондриальных белков
ГБОУ ВПО «Ивановская государственная медицинская академия» Минздрава РФ, 153012 Иваново, Шереметевский пр., 8
Магний принципиально важен для поддержания функции митохондрий кардиомиоцитов. Дефицит магния провоцирует астению кардиомиоцитов, сопровождающую сердечно-сосудистую патологию. В настоящей работе представлены результаты впервые проведенного биоинформационного анализа магнийзависимых белков митохондрий. Результаты анализа имеют принципиальное значение для понимания фармакодинамических эффектов воздействия магния на функцию митохондрий.
Низкая обеспеченность клеток организма магнием неизбежно приводит к дефициту магния в митохондриях — своего рода «энергостанциях» клетки. Миокардиоциты, миоциты, нейроны и глия, клетки плаценты характеризуются максимальным содержанием митохондрий на клетку. Дефицит магния негативно сказывается на функционировании митохондрий, в частности, приводит к существенному снижению энергетического метаболизма миокарда.
Данные фундаментальных исследований позволяют предположить, что воздействие магния на митохондрии осуществляется путем влияния на энергетический метаболизм митохондрий [1, 2], синтез белка [3], активность определенных митохондриальных белков [4], электролитный баланс митохондрий [5], открытие митохондриальной поры [6] и апоптоз [7]. Проводимый в настоящей работе системно-биологический анализ митохондриальных белков полностью подтверждает эти механизмы воздействия магния на митохондрии, и, более того, указывает на такие экспериментально мало исследованные механизмы, как воздействие магния на «ремонт», т.е. восстановление, ДНК (в том числе фолатзависимый), метаболизм ряда микронутриентов в митохондриях и противовирусный иммунитет. Полученная информация о молекулярных механизмах воздействия магния существенно углубляет понимание фундаментальной фармакодинамики воздействия магния на митохондрии.
Материалы и методы
 Системно-биологический анализ магнийзависимых белков проводили с использованием метода анализа функциональных взаимосвязей [8] — одной из информационных технологий современной биоинформатики. Метод анализа функциональных взаимосвязей, соединяя данные различных уровней (данные о моногенных заболеваниях, биохимические данные о кофакторах белков, данные о функциях магнийсодержащих белков, симптоматике и критериям диагностики заболеваний и т.д.), позволяет систематически рассмотреть все возможные области применения препаратов магния. В целом для каждого белка протеома человека составляется последовательная цепь описаний: 1) аминокислотная последовательность белка; 2) список биохимически необходимых эссенциальных кофакторов белка (в том числе с указанием потребности ионов магния для активности рассматриваемого белка); 3) список моногенных заболеваний, связанных с полной или частичной потерей активности этого белка; 4) список клеточных функций белка (по базе данных Gene Ontology, GO и др.); 5) список отдельных симптомов заболеваний, список диагнозов по МКБ-10, а также другая информация из баз данных. Затем в полученной таблице выделяют магнийзависимые белки митохондрий и проводят их последующий анализ.
Системно-биологический анализ магнийзависимых белков проводили с использованием метода анализа функциональных взаимосвязей [8] — одной из информационных технологий современной биоинформатики. Метод анализа функциональных взаимосвязей, соединяя данные различных уровней (данные о моногенных заболеваниях, биохимические данные о кофакторах белков, данные о функциях магнийсодержащих белков, симптоматике и критериям диагностики заболеваний и т.д.), позволяет систематически рассмотреть все возможные области применения препаратов магния. В целом для каждого белка протеома человека составляется последовательная цепь описаний: 1) аминокислотная последовательность белка; 2) список биохимически необходимых эссенциальных кофакторов белка (в том числе с указанием потребности ионов магния для активности рассматриваемого белка); 3) список моногенных заболеваний, связанных с полной или частичной потерей активности этого белка; 4) список клеточных функций белка (по базе данных Gene Ontology, GO и др.); 5) список отдельных симптомов заболеваний, список диагнозов по МКБ-10, а также другая информация из баз данных. Затем в полученной таблице выделяют магнийзависимые белки митохондрий и проводят их последующий анализ.
Результаты
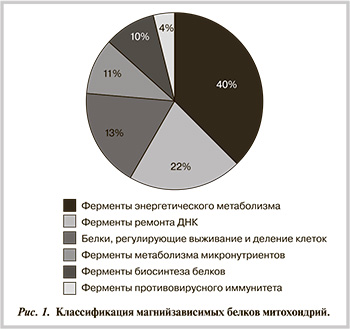
В результате анализа выделено 70 магнийзависимых белков, большинство из которых — ферменты. Все рассматриваемые белки локализованы внутри митохондрий (на наружной мембране митохондрий, в митохондриальном матриксе и др.). Для каждого из этих белков ион магния является кофактором, существенно влияющим на биологическую активность этого белка/фермента. Магнийзависимые белки митохондрий подразделяются на следующие группы:
- ферменты энергетического метаболизма;
- ферменты «ремонта« ДНК (в том числе фолатзависимого);
- белки, регулирующие выживание клеток и митохондрий;
- ферменты, участвующие в метаболизме микронутриентов в митохондриях;
- ферменты биосинтеза митохондриальных белков;
- ферменты противовирусного иммунитета (рис. 1).
Магнийзависимые митохондриальные ферменты энергетического метаболизма. Активность магнийзависимых ферментов метаболизма жирных кислот (ЖК), цикла трикарбоновых кислот (Кребса) и таких ферментов, как креатинкиназа, гексокиназа и др. (табл. 1), принципиально важна для энергетического метаболизма митохондрий. Ферменты энергетического метаболизма составляют 1/3 всех известных магнийзависимых белков митохондрий и подразделяются на ферменты метаболизма ЖК, цикла трикарбоновых кислот и ферменты, осуществляющие другие реакции (в частности, биосинтез кардиолипина).
Метаболизм ЖК. В условиях атерогенной диеты недостаток в пище магния способствует прогрессированию атеросклеротического поражения сердечно-сосудистой системы. И наоборот, дотации магния, калия, кальция приводят к регрессу гиперхолестеринемии; снижается уровень три-глицеридов [9—11]. Ионы Mg2+ необходимы, в частности, для активации участвующих в метаболизме ЖК ферментов митохондрий: кофермент А (КоА)-лигаз длинноцепочечных ЖК (гены ACSL1, ACSL3, ACSL4, ACSL5, ACSL6) и ацил-коА-синтазы (гены ACSM1, ACSM2A, ACSM2B, ACSM3 и ACSM5). Данные ферменты осуществляют липогенез в печени и необходимы для включения ЖК в фосфатидилхолин — основной фосфолипид клетки.
Ацил-КоА-лигазы длинноцепочечных ЖК активируют цепи ЖК для деградации через путь β-окисления. КоА-лигазы различаются в специфичности к субстрату: например, ACSL1 использует преимущественно пальмитолеат, олеат и линолеат; ACSL3 — преимущественно миристат, лаурат, арахидонат и эйкозапентаеноат, в то время как ACSL5 имеет очень широкий диапазон субстратов, включающий почти все биологически важные на...












