Фарматека №7 (360) / 2018
Системная терапия распространенного рака яичников у носительниц мутаций в гене BRCA1 – новые лечебные подходы: результаты проспективного нерандомизированного многоцентрового исследования
1 Национальный медицинский исследовательский центр онкологии им. Н.Н. Петрова, Санкт-Петербург, Россия;
2 Ленинградский областной онкологический диспансер, Санкт-Петербург, Россия;
3 Санкт-Петербургское государственное учреждение здравоохранения «Городской клинический онкологический диспансер», Санкт-Петербург, Россия;
4 Санкт-Петербургский государственный университет им. И.П. Павлова, Санкт-Петербург, Россия
BRCA1-ассоциированные опухоли демонстрирую уникальную чувствительность к препаратам платины, однако общая эффективность лечения остается ограниченной. Несмотря на выраженный регресс опухоли, стандартная терапия на основе препаратов платины редко приводит к патоморфологическим полным ответам. Цель исследования: оценить клиническую эффективность, безопасность, частоту полных патоморфологических ответов новой схемы неоадъювантной терапии больных BRCA1-ассоциированного рака яичников (РЯ) комбинацией митомицина С и цисплатина. Методы. В исследование вошли 217 больных РЯ, которые проходили лечение в течение 2015–2017 гг. В исследовании участвовали три онкологических центра. Все больные РЯ были подвергнуты тестированию методом полимеразной цепной реакции на предмет наличия мутаций: BRCA1 c.5266dupC [5382insC], c.4034delA [4153delA], c.181T> G [C61G], c.68_69delAG [185delAG] до начала лечения. Из 217 больных была идентифицирована 21 (10%) носительница мутаций, 12 (57%) пациенток получали комбинацию митомицина С 10 мг/м2 и цисплатина 100 мг/м2 каждые
4 недели в неоадъювантном режиме. Результаты проспективного исследования НАХТ BRCA1-ассоциированного с РЯ комбинацией митомицина С и цисплатина были сопоставлены с ретроспективными данными (n=62) НАХТ BRCA1-ассоциированного с РЯ, подвергнутой стандартной неоадъювантной терапии. Результаты. Все 12 больных РЯ продемонстрировали объективный клинический ответ на лечение. Полная циторедуктивная операция была достигнута в отношении всех пациенток, включенных в исследование. Патологическая оценка тканей, удаленных во время операции, установила полный патоморфологический ответ (pСR) в 2 (17%) из 12 случаев. Кроме того, у одной больной был зафиксирован полный патологический ответ в яичниках и почти полный ответ в сальнике. В целом от 5 (42%) больных получен выраженный патоморфологический ответ (оценка 3, согласно [12]). Заключение. Сочетание платиновых дуплетов в сочетании с другими препаратами, активность которых не ограничивается клетками с дефицитом BRCA1, может стать перспективным химиотерапевтическим подходом. Использование платино-таксановых схем, которые являются текущим «золотым» стандартом, по-видимому, не превосходит другие режимы по эффективности у носительниц мутаций в гене BRCA1.
Введение
Первичная циторедуктивная операция с последующим проведением системной лекарственной терапии на основе препаратов платины считается предпочтительной стратегией лечения больных распространенным раком яичников (РЯ) [1, 2]. Однако даже обширная хирургическая операция не может приводить к оптимальному удалению опухоли при распространенном париетальном и висцеральном канцероматозе [3]. В этих условиях неоадъювантная химиотерапия (НАХТ) служит разумным методом выбора, поскольку способна критически уменьшить объем опухоли и обеспечить эффективное и безопасное хирургическое вмешательство [4]. НАХТ, по-видимому, имеет некоторые недостатки, т.к. может скрыть потенциально опасные очаги опухоли от хирургического лечения и привести к развитию платинорезистентных опухолевых клонов. Однако в практике НАХТ часто используется как единственный возможный вариант лечения. Важно отметить, что НАХТ особенно информативна для изучения новых цитостатиков и их комбинаций, т.к. такая терапия позволяет оценивать изменения в опухолевой ткани, в т.ч. и на молекулярном уровне [5].
BRCA1-ассоциированные опухоли демонстрирую уникальную чувствительность к препаратам платины, однако общая эффективность лечения остается ограниченной. В частности, продолжительность ответа опухоли на лечение обычно ограничена несколькими месяцами [6]. Кроме того, несмотря на выраженный регресс опухоли, стандартная терапия на основе препаратов платины редко приводит к патоморфологическим полным ответам (pCR – pathologic complete response) [5]. В частности, при BRCA1-ассоциированном РЯ часть клеток даже в хемонаивных опухолях быстро приобретает резистентность во время НАХТ [7]. Неудивительно, что большинство больных распространенным РЯ неизбежно рецидивируют, если НАХТ не приводит к pCR [5]. Несмотря на то что pCR является единственной допустимой конечной точкой для исследований НАХТ, было признано, что полная циторедукция во время интервальной операции по удалению опухолей является значительным предиктором для продолжительной выживаемости без рецидива [4, 8].
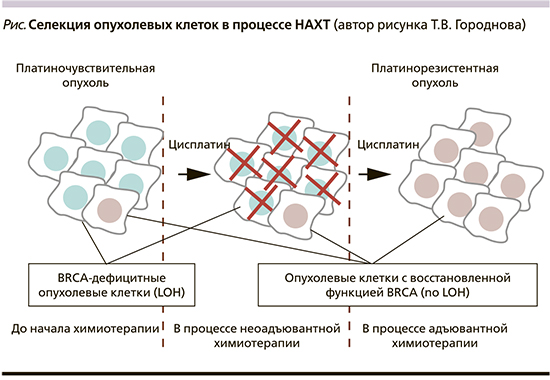
По всей видимости, важно уделять внимание биологическим свойствам остаточных элементов опухоли после НАХТ у больных РЯ. BRCA1-ассоциированная опухоль содержит биологически различные популяции опухолевых клеток. Большая часть опухоли представлена BRCA1-дефицитными клетками (LOH), которые сразу же погибают в ответ на платиновую терапию. Но небольшая часть клеток в этих опухолях сохранила копию гена BRCA1 дикого типа (no LOH) [7, 9] (см. рисунок).
Платиносодержащие схемы НАХТ имеют высокую активность по отношению к клеткам с дефицитом BRCA1 (LOH), но не могут эффективно уничтожить остальные опухолевые клетки с неповрежденной функцией BRCA1 (no LOH) [7].
Методы
В исследование вошли 217 больных РЯ, которые проходили лечение в течение 2015–2017 гг. и по предиктивной оценке имели низкую вероятность выполнения оптимальной циторедукции [10].
В исследовании участвовали 3 онкологических центра: НМИЦ онкологии им. Н.Н. Петрова (Санкт-Петербург); Городской клинический онкологический диспансер, (Санкт-Петербург), Ленинградский областной онкологический диспансер (Санкт-Петербург).
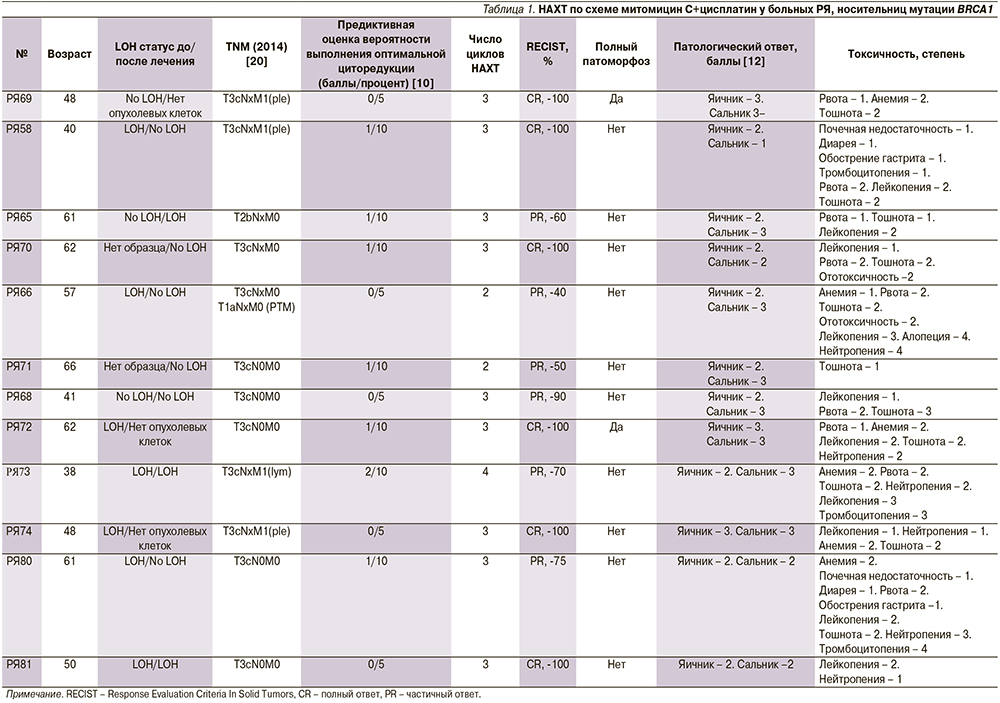
Все больные РЯ были подвергнуты тестированию на предмет наличия мутаций BRCA1 c.5266dupC [5382insC], c.4034delA [4153delA], c.181T> G [C61G], c.68_69delAG [185delAG] [11] до начала лечения. Поскольку этот анализ основан на нескольких простых тестах методом полимеразной цепной реакции, время обработки не превышало 3 рабочих дней. Из 217 больных была идентифицирована 21 (10%) носительница мутаций. Восемнадцать (86%) из них были хемонаивными к моменту генетического тестирования; 3 (14%) начали получать химиотерапию (ХТ) в другой клинике, но искали дополнительные варианты лечения из-за прогрес...












