Фарматека №4 / 2021
Современные медикаментозные подходы к контролю гликемии у больных сахарным диабетом 1 и 2 типов
1) Донецкий национальный медицинский университет им. М. Горького, Донецк, Донецкая Народная Республика;
2) Дорожная клиническая больница станции Донецк, Донецк, Донецкая Народная Республика
Основу лечения больных сахарным диабетом 1 (СД1) и 2 (СД2) типов составляет контроль уровней гликемии с применением современных сахароснижающих препаратов; широкое использование находят также изменения образа жизни и назначение органопротекторных лечебных подходов. Целью настоящего сообщения стало рассмотрение принципов медикаментозного контроля гликемии у лиц с СД. В статье изложены современные аспекты применения сахароснижающей терапии больных СД1 и СД2. Отдельное внимание уделено эффективности, а также безопасности применения сахароснижающих средств как в виде монотерапии, так и в различных комбинациях для лиц с СД и коморбидными состояниями. Наличие СД сопряжено с развитием тяжелых форм коронавирусной инфекции. У лиц с СД наблюдается более высокий темп прогрессирования пневмонии, чаще развиваются респираторный дистресс-синдром, острое повреждение почек, септический шок, диссеминированное внутрисосудистое свертывание. В статье представлены современные данные об особенностях ведения больных СД в условиях пандемии COVID-19 (профилактические и лечебные подходы), что представляет данную работу весьма актуальной для практического здравоохранения.
Обоснование
Сахарный диабет (СД) – одна из наиболее серьезных проблем клиники внутренних болезней [1–4]. Его распространенность в мире за последние 10 лет увеличилась не менее чем на 30% [1, 2]. Полагают, что доля лиц с СД среди взрослых в общей популяции составляет около 9,5%. В 2020 г. в США эта цифра достигала 14% (у 30,7% из них диабет еще не был диагностирован), а в некоторых странах Южной Азии – даже 30% [2]. В Российской Федерации число лиц с установленным диагнозом СД составляет около 4,5 млн (3,1% населения). Считается, что примерно у такого же (если не более значительного) числа больных диабет остается недиагностированным, что влечет за собой значительные недостатки в лечебной помощи [1, 4]. Риск развития СД в течение предстоящей жизни (по подсчетам для новорожденных в США) может достигать 32,8% у лиц мужского и 38,5% женского пола [2]. СД – известный независимый и мощный фактор риска развития поражений органов-мишеней [1–4]. Это признанный лидер среди причин слепоты в развитых странах [2]. Диабет – ведущая причина развития терминальной стадии почечной недостаточности, требующей лечения с замещением функции почек; доля лиц с диабетической нефропатией (ДНП) в структуре диализных больных и реципиентов почечных трансплантатов составляет около 40% [2]. Среди больных СД риск развития инфаркта миокарда и инсульта в 2–4 раза [2, 5], а риск ампутаций нижних конечностей – в 20 раз выше, чем у лиц без диабета [2, 6]. Ожидаемая продолжительность жизни больных СД в развитых странах примерно на 10 лет меньше, чем в отсутствие диабета. СД – серьезная экономическая проблема. Подсчитано, что затраты системы здравоохранения на человека с СД примерно в 2,3 раза выше, чем на лицо такого же пола и возраста, но без диабета; в мировом масштабе ежегодные затраты на лечение таких больных составляют громадную цифру >1,3 трлн долл. США (около 1,8% глобального валового внутреннего продукта – ВВП) [2].
Основу лечения больных СД 1 и 2 типов (СД1 и СД2) составляет контроль уровней гликемии с применением современных сахароснижающих препаратов (ССП) [1–3]; широкое использование находят и изменения образа жизни, и назначение органопротекторных лечебных подходов (антигипертензивных препаратов, включая блокаторы ренин-ангиотензин-альдостеороновой системы, статины, антитромбоцитарные и др.) [1–3, 5]. Цель: настоящего сообщения рассмотрение принципов медикаментозного контроля гликемии у лиц с СД.
Для контроля гликемии отечественные и международные эксперты рекомендуют оценку уровней гликированного гемоглобина (HbA1с) не реже 2 раз в год, а если целевые уровни не достигнуты или лечение было изменено, то 4 раза в год [1, 2]. Для большинства взрослых лиц с СД1 и СД2 целевым считают уровень HbA1с<7%. Для части больных, которым без значимых эпизодов гипогликемии и побочных эффектов лечения возможно достижение HbA1с <6,5%, этот уровень может быть приемлемой целью. Менее жесткий целевой уровень HbA1с (<8,0%) предпочтителен для лиц с эпизодами тяжелой гипогликемии в анамнезе с относительно небольшой ожидаемой продолжительностью жизни, отчетливыми микро- и макрососудистыми осложнениями СД, тяжелыми сопутствующими заболеваниями, длительно протекающим СД, при невозможности достижения более низких величин HbA1с, несмотря на применение комбинаций ССП, включая инсулины.
Для контроля гликемии может быть использована методика ее ежедневного самоконтроля (домашний глюкометр, тест-полоски, ведение дневника). Целевые уровни гликемии (в капиллярной крови), измеренной натощак, обычно составляют 4,4–7,2 ммоль/л, пиковая гликемия после еды (т.е. через 1–2 часа после начала еды) должна быть <10,0 ммоль/л [1, 2].
В течение последних лет для лиц с СД предложены различные системы непрерывного мониторинга уровня глюкозы в крови, в т.ч. с оценкой амбулаторного гликемического профиля (уровень гликемии определяется многократно в течение 14 дней, выстраиваются соответствующие кривые и подсчитываются индексы, весьма ценные для выбора лечебной тактики). Этот метод пока недостаточно доступен, но весьма перспективен; однако других методов оценки гликемии, рассмотренных выше, он не заменяет [1, 2].
Медикаментозный контроль гликемии при СД1
Поскольку для СД1 характерно полное или частичное отсутствие функции β-клеток островкового аппарата поджелудочной железы, применение инсулина абсолютно необходимо в лечении этих больных [1, 2, 7, 8]. При СД1 наряду с гипергликемией имеется инсулинопения, оказывающая ряд самостоятельных неблагоприятных метаболических эффектов, включая развитие гипертриглицеридемии, кетоацидоза и нарушений тканевого катаболизма [1, 2, 7, 8]. Эти тяжелые метаболические нарушения при СД1 могут эффективно предотвращаться ежедневными инъекциями инсулина. Накоплены убедительные свидетельства того, что более интенсивная тактика инсулин-заместительной терапии (включая неоднократное его введение в течение суток либо постоянное подкожное – п/к применение с использованием технологии инсулинового насоса) позволяет дополнительно существенно улучшать прогноз (со снижением риска развития микрососудистых осложнений СД на 50% за 6 лет лечения) [2, 7, 8].
В настоящее время разработаны и внедрены в клиническую практику многочисленные варианты аналогов инсулина (ультракороткого и длительного действий, см. табл. 1), которые по фармакокинетике отличаются от ранее доминировавших рекомбинантных человеческих инсулинов (короткого и среднего по продолжительности действий) [2, 7, 8].
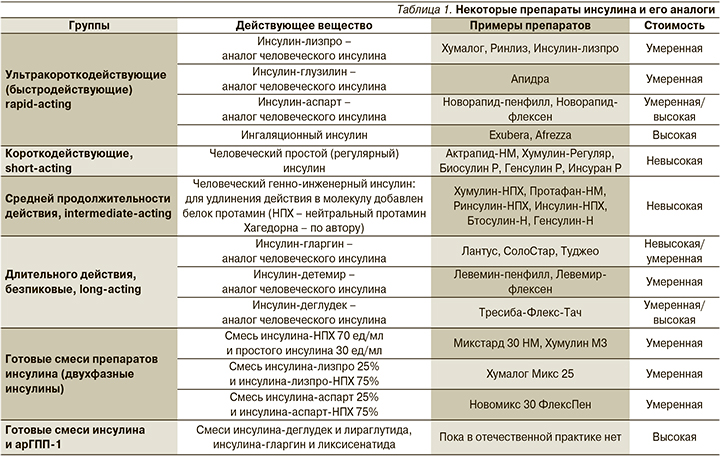
Ультракороткие формы имеют более быстрое начало действия и более короткую его продолжительность по сравнению с простым инсулином; препараты длительного действия (безпиковые, базальные) по сравнению с НПХ-инсулинами (НПХ – «нейтральный протамин Хагедорна») отличаются большей продолжительностью и плавностью эффекта. Показано, что при СД1 применение аналогов инсулина ассоциировано с меньшим риском развития гипогликемии и увеличения массы тела, а также с улучшением контр...
7%.>











