Клиническая Нефрология №1 / 2014
Современные подходы к терапии АНЦА-ассоциированных системных васкулитов
Клиника нефрологии, внутренних и профессиональных болезней им. Е.М. Тареева, УКБ № 3, Первый МГМУ им. И.М. Сеченова; Кафедра внутренних, профессиональных болезней и пульмонологии МПФ, Первый МГМУ им. И.М. Сеченова, Москва; Кафедра внутренних болезней ФФМ МГУ им. М.В. Ломоносова, Москва
Представлены современные терапевтические стратегии, применяющиеся при АНЦА-ассоциированных системных васкулитах, в т.ч. подходы к их выбору в зависимости от нозологической формы, распространенности и тяжести органных поражений. Представлены результаты основных контролируемых клинических исследований. Подробно обсуждены перспективы применения таргетных биологических препаратов.
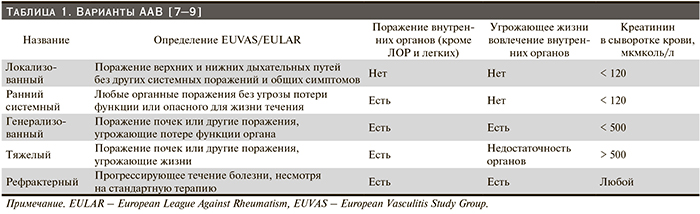
АНЦА-ассоциированные васкулиты (ААВ) – группа заболеваний, которая характеризуется наличием воспалительного поражения сосудов мелкого и среднего калибра и частым обнаружением антинейтрофильных цитоплазматических антител (АНЦА). К ААВ относят гранулематоз с полиангиитом (Вегенера), микроскопический полиангиит и эозинофильный гранулематоз с полиангиитом (Черга–Страусс) [1, 2]. ААВ – угрожающие жизни заболевания, в отсутствие терапии смертность достигает 80 % к первому году болезни [3]. Стандартная иммуносупрессивная терапия включает назначение комбинации высоких доз глюкокортикоидов и цитостатиков (чаще всего циклофосфамида) для индукции ремиссии с заменой последнего на азатиоприн или метотрексат для поддержания ремиссии [4–6]. В зависимости от распространенности и тяжести органных поражений выделяют несколько вариантов ААВ (табл. 1), различающихся в т.ч. по объему иммуносупрессивной терапии (табл. 2).
Эффективность стандартной терапии подтверждена в клинических исследованиях (результаты обобщены в табл. 3), частота достижения ремиссии составляет 80–90 %, а смертность снизилась до 25 % к пятому году болезни, однако у многих пациентов возникают рецидивы и необходимо продолжительное иммуносупрессивное лечение [25–27].
Иммуносупрессивная терапия обладает многочисленными ранними и поздними нежелательными эффектами, которые могут утяжелять течение болезни, повреждение внутренних органов и прогноз. Несмотря на поддерживающую терапию, по крайней мере у 10 % пациентов ежегодно возникает рецидив [32]. Минимизация дозы и продолжительности приема глюкокортикоидов имеет ключевое значение для снижения риска инфекционных осложнений, сердечно-сосудистых заболеваний и других нежелательных эффектов, снижающих качество жизни [33, 34]. При этом следует помнить, что, по данным мета-анализа [35], полная отмена глюкокортикоидов сопровождается повышенным риском рецидива, однако оптимальная продолжительность и дозы препаратов для поддерживающей терапии не установлены.
Таким образом, наиболее актуальные проблемы традиционной неселективной иммуносупрессивной терапии обобщены в табл. 4.
В связи с потребностью улучшения исходов терапии ААВ продолжается активное изучение патогенеза этой группы заболеваний, в частности, продемонстрированы многочисленные изменения в функционировании В- и Т-лимфоцитов, нейтрофилов и комплемента (особенно альтернативного пути). Моноклональные антитела к CD20-рецепторам В-лимфоцитов (ритуксимаб) в настоящее время одобрены для использования при ААВ, продолжается активное изучение перспективных препаратов с более избирательным действием по сравнению с традиционными иммуносупрессивными средствами.
Терапия, направленная на В-лимфоциты
Наличие В-лимфоцитов в очагах воспаления [36, 37], корреляция активации В-лимфоцитов с активностью ГПА [38], эффективность ЦФ, относительно специфично воздействующего на В-лимфоциты [39], и значение аутоантител (АНЦА к миелопероксидазе/протеиназе-3) в патогенезе ААВ обосновывают возможность воздействия на В-лимфоциты. После получения очень обнадеживающих результатов в сериях наблюдений, ретроспективных исследованиях [40–45] было проведено два крупных рандомизированных исследования, в которых оценивалась эффективность ритуксимаба (РТМ) для индукции ремиссии у пациентов с впервые установленным диагнозом ААВ и при развитии рецидива. Оба исследования, RAVE [13] и RITUXVAS [14], продемонстрировали близкие показатели частоты достижения ремиссии в группах РТМ и ЦФ (в сочетании с высокой дозой ГК) у пациентов с впервые установленным диагнозом. В исследовании RAVE также было установлено, что РТМ превосходит ЦФ по эффективности в случае рецидивирующего течения ААВ. При этом различий по безопасности между группами РТМ и ЦФ установлено не было, что позволяет говорить о терапии высокими дозами ГК как о ключевом модифицируемом факторе нежелательных эффектов при ААВ.
РТМ как препарат индукции ремиссии предпочтителен при рецидивирующем течении ААВ и при впервые установленном диагнозе, когда ограничена возможность применения ЦФ. Результаты продолженного наблюдения в рамках исследования RAVE показывают, что один курс РТМ не уступает продолжительному лечению ЦФ с последующим переходом на прием АЗА в поддержании ремиссии на протяжении 18 месяцев [46]. При этом рецидивы могут возникать через 6–12 месяцев после индукционной терапии, особенно после восстановления В-лимфоцитов и повышения титра АНЦА, хотя необязательно [46, 47]. Оптимальная терапия для поддержания ремиссии после индукции РТМ в настоящее время не установлена. Ретроспективные исследования рецидивирующих ААВ свидетельствуют, что повторные введения РТМ снижают риск рецидива, при этом введения РТМ могут выполняться регулярно через равные интервалы времени (обычно каждые 6 месяцев) [47–50] или по факту повышения титра АНЦА, или возврата В-лимфоцитов [51]. Возможно, повторные введения РТМ части пациентов могут приводить к персистирующе...












