Терапия №8 / 2024
Современные возможности снижения резидуального сердечно-сосудистого риска
1) ФГАОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России, г. Москва;
2) ФГБУ ДПО «Центральная государственная медицинская академия» Управления делами Президента РФ, г. Москва;
3) ФГБУ «Поликлиника № 1» Управления делами Президента РФ, г. Москва
Аннотация. Статинотерапия надежно снижает концентрацию холестерина липопротеидов низкой плотности, но не всегда эффективна в плане улучшения общего липидного профиля, что создает предпосылки к формированию резидуального (остаточного) кардиоваскулярного риска. Фибраты – агонисты активируемого пероксисомным пролифератором рецептора-α – являются мощными липид-модифицирующими препаратами. К их основным эффектам относятся снижение уровня триглицеридов и повышение уровня липопротеидов высокой плотности. Несколько рандомизированных контролируемых исследований не продемонстрировали преимущества фибратов в снижении сердечно-сосудистого риска, особенно в качестве дополнения к терапии статинами. Однако ретроспективные анализы крупных клинических исследований, метаанализы и данные исследований реальной практики свидетельствуют об их терапевтическом потенциале в популяциях пациентов с атерогенной дислипидемией и метаболическим синдромом. В обзоре представлен анализ актуальной научной литературы по проблеме коррекции смешанной дислипидемии и риска сердечно-сосудистых осложнений.
ВВЕДЕНИЕ
Эффективная терапия нарушений липидного обмена является приоритетом в первичной и вторичной профилактике сердечно-сосудистых заболеваний (ССЗ), ассоциированных с атеросклерозом. Согласно данным эпидемиологического исследования ЭССЕ-РФ, проведенного в 13 регионах России с участием 21 048 человек, у 75% россиян повышен уровень холестерина липопротеидов низкой плотности (ХС ЛНП) и/или триглицеридов (ТГ). При этом по распространенности и значимости на 1-м месте среди нарушений липидного обмена находится гиперхолестеринемия (общий холестерин ≥ 5,0 ммоль/л или ХС ЛНП ≥ 3,0 ммоль/л) – 58%, на 2-м – гипертриглицеридемия (ТГ ≥ 1,7 ммоль/л) – 25–30%, на 3-м – гиперлипопротеидемия (а) (липопротеид (а) > 30 мг/дл) – 21% [1, 2]. Изолированное повышение ХС ЛНП кодируется как «Е78.0 Гиперлипидемия 2а типа». В случае увеличения содержания богатых ТГ частиц следует использовать один из четырех шифров Е78.1–78.4; при изолированном повышении ТГ тип нарушения определяется как гипертриглицеридемия (ГТГ), при сочетанном повышении ХС ЛНП и ТГ – как смешанная гиперлипидемия.
МАРКЕРЫ РЕЗИДУАЛЬНОГО СЕРДЕЧНО-СОСУДИСТОГО РИСКА
У многих пациентов со смешанной гиперлипидемией даже при достижении целевых значений ХС ЛНП сохраняется резидуальный (остаточный) кардиоваскулярный риск, т. е. опасность дальнейшего прогрессирования атеросклероза и развития связанных с ним осложнений. Согласно результатам Framingham Study, уровень ТГ > 1,7 ммоль/л (> 150 мг/дл) свидетельствует о повышенном риске сердечно-сосудистых осложнений (ССО) и диктует необходимость поиска причин ГТГ [3].
Первичные формы ГТГ полигенны, вызваны гиперпродукцией липопротеидов очень низкой плотности (ЛОНП), нарушением гидролиза ТГ, клиренса ремнантов ТГ в печени и, как правило, сопровождаются высокой, часто изолированной ГТГ, нередко приводящей к острому панкреатиту [4]. Гораздо чаще в практике встречается вторичная ГТГ, обусловленная избыточным потреблением простых углеводов, повышенной массой тела, инсулинорезистентностью и ассоциированными с ней состояниями, злоупотреблением алкоголем. Более редкими этиологическими факторами этой формы ГТГ являются гипотиреоз, аутоиммунные заболевания, хроническая болезнь почек, беременность (особенно III триместр), длительное применение ряда лекарственных препаратов (глюкокортикоидов, эстрогенов, фенотиазинов, антипсихотиков II поколения, тамоксифена, тиазидных диуретиков, бета-адреноблокаторов, циклоспорина, ингибиторов протеаз) [5].
Как известно, преобладающая часть циркулирующих ТГ находится в составе циркулирующих ApoB-содержащих транспортных форм, богатых ТГ, к которым, помимо ЛНП, относятся ЛОНП и ремнанты; гидрофобность этих частиц позволяет им легко преодолевать эндотелиальный барьер и инициировать атерогенез, а также способствовать его прогрессированию [6].
Немало исследований в области резидуального сердечно-сосудистого риска, в том числе с менделевской рандомизацией, позволяют предположить причинную связь между риском ишемической болезни сердца (ИБС) и уровнем ТГ в плазме [7, 8]. Эти данные интерпретировались с осторожностью, так как риск ИБС, ассоциированный с ТГ, также ассоциировался с уровнями ХС ЛВП, ХС ЛНП или липопротеина (а) (Лп (а) [9, 10].
Кроме того, есть предположение, что генетические варианты, ассоциированные с повышением уровня ТГ, также связаны с возрастанием ХС ЛНП и/или снижением концентрации холестерина липопротеидов высокой плотности (ХС ЛВП), на что указывают исследования с менделевской рандомизацией [11, 12].
Однако в последнее время наблюдается эволюция подхода к оценке риска при ГТГ [13, 14]. Например, в недавнем крупномасштабном исследовании группы Wadstrom B.N. et al. (2023) с периодом наблюдения до 13 лет, в которое были включены 87 192 человека в возрасте 20–69 лет из Копенгагенской популяционной когорты, сделан вывод, что повышенный уровень остаточного холестерина (≥ 1 ммоль/л, или ≥ 39 мг/дл) в плазме, имеющийся у 28% населения, независимо ассоциирован с двукратным ростом относительного риска смерти от сердечно-сосудистых причин, инфекционных заболеваний и эндокринной патологии, но не от рака (рис. 1). При этом результаты для уровня триглицеридов плазмы > 2 и < 1 ммоль/л (> 177 и < 89 мг/дл) были схожими [15].
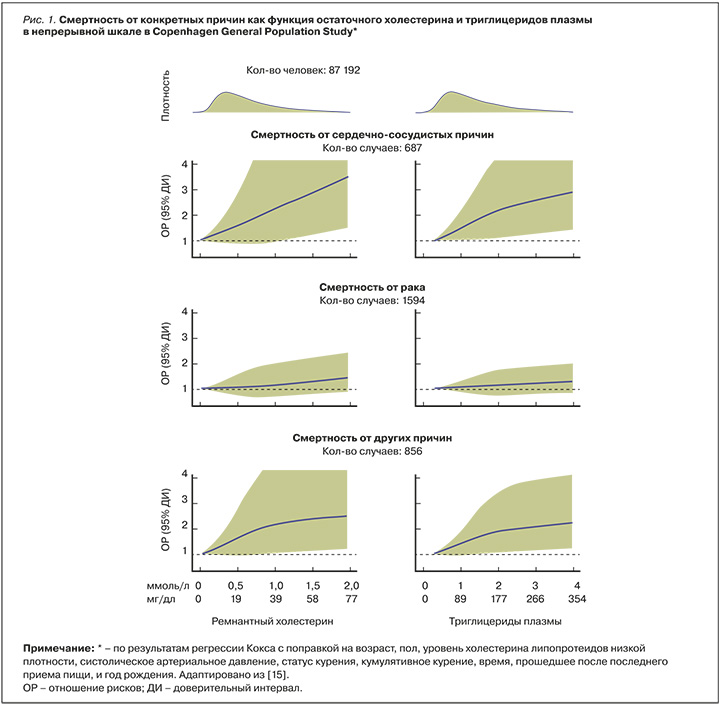
В современной литературе используется по меньшей мере восемь различных определений термина «остаток» применительно к липопротеидным частицам [16]. В обсуждаемой работе и по определению Varbo A. et al. (2013) под термином «остаточный холестерин» подразумевается содержание холестерина в ЛОНП, хиломикронах и липопротеидах промежуточной плотности (ЛПП), а следовательно, холестерина, переносимого всеми липопротеидами, богатыми триглицеридами, но не ЛНП (рис. 2) [10, 15]. Этот «остаточный холестерин» можно либо измерить («прямой остаточный холестерин»), либо приблизительно рассчитать путем деления общего количества ТГ сыворотки в мг/дл н...












