STROKE №4 / 2017
Стойкое улучшение неврологических функций после инсульта у пожилых крыс после введения нового аналога простациклина
Departments of Neuroscience, Anesthesiology and Psychiatry, University of Florida, Gainesville.
Предпосылки и цель исследования. Воздействие на простагландин I2 простаноидный рецептор (IP) с целью уменьшения повреждения головного мозга при инсульте было трудно осуществить из-за отсутствия селективных препаратов. MRE-269 — активный метаболит селексипага, с высокой селективностью в отношении IP-рецепторов. Недавно селексипаг был одобрен для клинического применения при легочной гипертензии. Мы предположили, что применение MRE-269 после развития ишемического повреждения обеспечит длительную нейропротекцию с улучшением неврологических исходов в клинически значимой модели инсульта у крыс. Методы. Пожилым самцам крыс линии Sprague-Dawley выполнили транзиторную окклюзию средней мозговой артерии, а затем произвольным образом животных распределили в группы внутривенного введения плацебо или MRE-269 (0,25 мг/кг), начиная с 4,5 ч после индукции ишемии. Тесты с ускоряющимся вращением стержня и тест на удаление липкой ленты проводили до и через 3, 7, 14 и 21 день после развития инсульта. Объем очага инфаркта оценили количественно по данным магнитно-резонансной томографии, выполненной через 48 ч и 21 день после окклюзии средней мозговой артерии. В параллельных экспериментах, образцы коры головного мозга полушарий с инсультом и без инсульта у крыс группы MRE-269 и плацебо извлекали через 18 ч после окклюзии средней мозговой артерии для проведения молекулярно-биологического анализа. Результаты. Результаты количественной оценки данных магнитно-резонансной томографии показали, что введение MRE-269 после индукции ишемии привело к значительному уменьшению объема очага инфаркта, по сравнению с крысами получавшими плацебо, через 48 ч и 3 недели после инсульта. Результатом введения MRE-269 стало достоверное улучшение локомоторных и соматосенсорных функций в отдаленном периоде, после окклюзии средней мозговой артерии, которое было ассоциировано со снижением потери веса у животных, получавших агонист IP-рецептора. Введение MRE-269 поле развития ишемии приводило к снижению содержания провоспалительных цитокинов/хемокинов и уменьшению выраженности окисидантного стресса. Повреждение гематоэнцефалического барьера, критерием которого была экстравазация иммуноглобулина G в ишемизированный головной мозг, было значительно менее выражено на фоне введения MRE-269, что было ассоциировано с уменьшение активности матричной металлопротеиназы-9 в головном мозге пожилых крыс с инсультом, получавших агонист IP через 4,5 ч после индукции ишемии. Выводы. Полученные данные свидетельствуют о том, что воздействие на IP-рецепторы посредством MRE-269 является новой стратегией уменьшения выраженности церебрального ишемического повреждения и способствует улучшению неврологических функций при ишемическом инсульте в отдаленном периоде.
Простациклин, также известный как простагландин I2 (PGI2), представляет собой эйкозаноид, синтезируемый из арахидоновой кислоты, который преимущественно продуцируется эндотелием [1]. PGI2 индуцирует вазодилатацию, является ингибитором агрегации тромбоцитов и снижает проницаемость микрососудов [1]. У мышей с дефицитом простаноидного рецептора PGI2 (IP) выявили более интенсивную гибель нейронов после ишемии головного мозга [2, 3]. Кроме того, применение аналогов PGI2 приводило к значительному уменьшению тяжести ишемического повреждения головного мозга [2, 4-6]. Однако использование PGI2 и известных аналогов имеет ограниченную терапевтическую значимость в связи с химической нестабильностью, быстрым метаболизмом (t½≈4 мин) [1] и отсутствием селективности в отношении IP-рецепторов, приводящее к развитию опасных побочных эффектов [7]. K. Kuwano и соавт. разработали новый, проникающий в головной мозг высокоселективный агонист IP-рецепторов, кодированный как NS-304 (селексипаг), пролекарство активного метаболита, называемого MRE-269, который наиболее активен в диапазоне низких доз – нмоль/л [8]. При изучении фармакокинетики на крысах, собаках и у людей продемонстрировали значительное увеличение t½ от 6 до 8 ч [7, 8]. После успешных клинических испытаний [9, 10] селексипаг/MRE-269 был одобрен для применения Управлением по контролю за пищевыми продуктами и лекарственными препаратами США.
В модели эксайтотоксического повреждения головного мозга у животных MRE-269 оказывал нейропротекторное действие [11], что имеет большое значение, поскольку эксайтотоксичность способствует гибели нейронов при инсульте. Имеются ограниченные данные о защитных механизмах и потенциальном воздействии на сигнальные пути IP-рецепторов для снижения тяжести повреждения при инсульте и стойкого улучшения неврологических функций. Мы предположили, что введение MRE-269 после развития ишемии обеспечит длительную нейропротекцию с улучшением неврологических исходов после ишемического инсульта (ИИ). В модели ИИ у пожилых крыс мы обнаружили, что MRE-269 приводил к значительному уменьшению объема очага инфаркта и выраженному длительному улучшению локомоторных и соматосенсорных функций после окклюзии средней мозговой артерии (ОСМА). Нейропротекция при введении MRE-269 при ИИ была обусловлена снижением содержания провоспалительных цитокинов/хемокинов и уменьшением выраженности оксидантного стресса. Более того, применение MRE-269 после развития ишемии привело к значительному снижению активности матричных металлопротеиназ-9 (MMP-9) в головном мозге и уменьшению выраженности повреждения гематоэнцефалического барьера (ГЭБ) при инсульте. В совокупности, эти данные показывают, что воздействие на IP-рецепторы посредством введения MRE-269 является новой стратегией для уменьшения выраженности ишемического повреждения головного мозга, что способствует стойкому улучшению неврологических функций при ИИ.
МЕТОДЫ
Подробное описание всех экспериментов представлено в дополнительных данных on-line. Краткое описание основных методик приведено ниже.
Животные и модель ОСМА
Все экспериментальные процедуры проводили в соответствии со стандартами Национальных институтов здравоохранения, а протоколы экспериментов были одобрены Комитетом по содержанию и использованию лабораторных животных Университета Флориды. Расчет предварительного размера выборки выполнили с использованием программного обеспечения G* Power V.3.1.3 [12], алгоритм которого подробно описан в разделе «Методы» в дополнительных данных on-line. В общей сложности 57 пожилых самцов крыс линии Sprague-Dawley (18–20 месяцев, Hilltop Laboratories, Scottdale, PA) использовали в настоящем исследовании и произвольным образом распределяли в группы лечения. Транзиторную ОСМА в течение 90 мин индуцировали путем введения нити с силиконовым покрытием в просвет сосуда методом, описанным нами ранее [13].
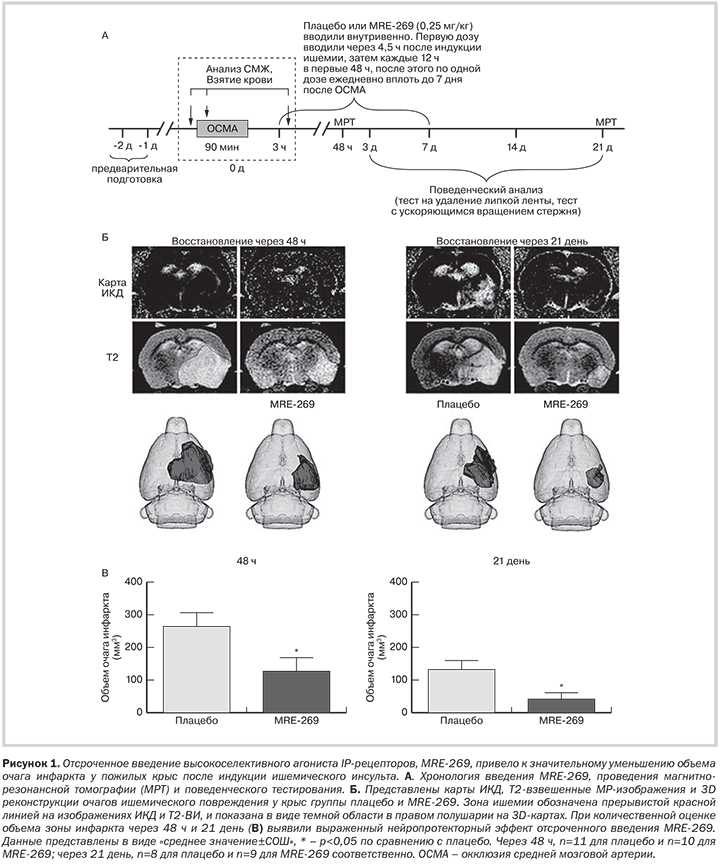
Дизайн эксперимента и введение препаратов
Для внутривенного введения плацебо или MRE-269 во время процедуры ОСМА в правую бедренную вену крыс с ишемией головного мозга устанавливали катетер. MRE-269 ([4-[(5,6-дифенилпиразинил) (1-метилэтил) амино] бутокси] уксусная кислота; Cat. № 10010412; Cayman Chemical, Ann Arbor, MI) растворяли в диметилсульфоксиде и затем разводили в стерильном физиологическом растворе. Для определения размера очага инфаркта и проведения нейроповеденческих тестов 26 крысам выполнили транзиторную ОСМА и далее крыс случайным образом распредели в группы лечения, с последующим введением 1% диметилсульфоксида в физиологическом растворе (n=13) или MRE-269 (0,25 мг/кг, n=13), начиная с 4,5 ч после развития ОСМА. К...












