Акушерство и Гинекология №1 / 2014
Структурно-молекулярные перестройки в полипах и окружающем эндометрии в постменопаузе: процессы пролиферации, неоангиогенеза, старения и апоптоза
ФГБУ Научный центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова Минздрава России, Москва
Цель исследования. Морфологическое изучение процессов роста, неоангиогенеза, старения и апоптоза в полипах и окружающем их эндометрии у женщин в постменопаузе.
Материал и методы. Обследованы 46 пациенток: I группа – пациентки с аденоматозными полипами (АП) (N=11), II группа – с фиброзно-железистыми полипами (ФЖП) (N=17), III группа (контрольная) – с атрофичным эндометрием без полипов (N=18). Оценивались экспрессия маркеров Ki-67, VEGF, ApoCas, PTEN и p16INK4a в эпителиальных и стромальных клетках полипа, окружающего его эндометрия и контрольного эндометрия.
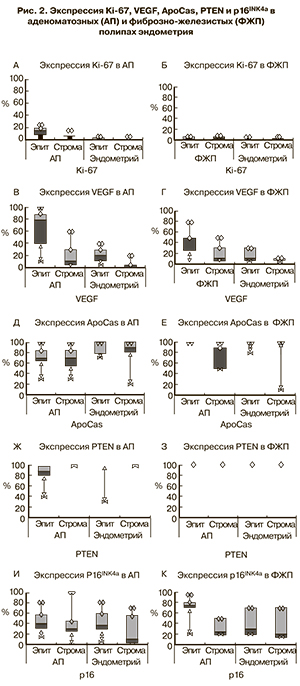
Результаты. Эпителий АП имеет высокий уровень пролиферации, низкую степень апоптоза, а в некоторых случаях изменения, характерные для злокачественной трансформации клеток (потеря PTEN, коэкспрессия p16INK4a и Ki-67). Определена существенная разница между эндометрием, окружающим АП и ФЖП, который в свою очередь отличается от контрольного эндометрия.
Заключение. АП и ФЖП имеют различные механизмы патогенеза и отличаются не только по морфологическому строению, но и по экспрессии маркеров роста, неоангиогенеза, старения и апоптоза в их стромальном и эпителиальном компонентах. Полученные данные следует рекомендовать для усовершенствования дифференцированного подхода к их лечению и решению вопроса об объеме деструкции эндометрия при данной патологии.
Полипы эндометрия (ПЭ) занимают первое место среди внутриматочной патологии у пациенток пожилого возраста и встречаются с частотой 39,2–69,3% [1, 2], а у женщин с кровотечением в постменопаузе – с частотой от 16 до 54% [2–6].
ПЭ рассматривают как локальную доброкачественную опухоль, исходящую из базального слоя эндометрия. Вопрос о клеточном источнике развития ПЭ до настоящего времени не изучен. J. Fletcher утверждает, что полипы эндометрия представляют собой моноклональные образования из генетически поврежденных стромальных клеток эндометрия, с вторичным вовлечением железистого эпителия [7]. Хромосомный анализ стромы полипов выявил в большинстве случаев клональные транслокации, включающие в себя регионы 6р21-22, 12q13-15 или 7q22 [8].
У женщин в постменопаузе механизмы патогенеза ПЭ недостаточно изучены, а гипотеза эстрогенной стимуляции в развитии ПЭ в постменопаузе может рассматриваться как парадоксальная [9]. В литературе обсуждаются механизмы автономности роста ПЭ за счет гиперпродукции факторов роста с одновременной экспрессией и относительного снижения уровня апоптоза. Высказано предположение, что дисбаланс между факторами пролиферативного ответа и апоптоза в сторону первого на ограниченном участке является одним из патогенетических факторов, лежащих в основе развития ПЭ в репродуктивном возрасте [10]. Однако данный факт в ПЭ у женщин в постменопаузе практически не изучался [9]. В проведенных ранее исследованиях по изучению рецепторов к стероидным гормонам, экспрессии маркеров пролиферации и апоптоза в ПЭ получены весьма противоречивые данные [10–14]. Это можно объяснить тем, что в группы объединялись больные с давностью постменопаузы от 1 года до 47 лет, больные с приемом ЗГТ или тамоксифена в анамнезе, а самое главное, как мы считаем, это отсутствие учета гистологического типа ПЭ.
Целью нашего исследования стало морфологическое изучение процессов роста, неоангиогенеза, старения и апоптоза в полипах и окружающем их эндометрии у женщин в постменопаузе.
Материал и методы
 В исследовании были включены 46 женщин, из них в основную группу – 28 морфологически подтвержденных случаев ПЭ. При разделении ПЭ на подгруппы нами была принята рабочая классификация, по которой были определены 2 группы: аденоматозные (АП) – 11 случаев и фиброзно-железистые (ФЖП) – 17 случаев. В группу сравнения были отобраны 18 пациенток в постменопаузе (более 10 лет) без патологии эндометрия (контрольный эндометрий – КЭ), которым было проведено оперативное лечение по поводу пролапса гениталий. Критериями включения в группу с ПЭ были: постменопауза более 10 лет, наличие ПЭ на фоне атрофичного эндометрия. Критерии включения в группу без ПЭ: постменопауза более 10 лет, атрофичный эндометрий. Критериями исключения для всех групп были: прием гормонально активных препаратов (ЗГТ, тамоксифен) в анамнезе, прием НПВС в течение последних 6 месяцев, гиперплазия эндометрия, аденокарцинома эндометрия, сопутствующие миома матки и аденомиоз, хронический эндометрит, опухоли яичников.
В исследовании были включены 46 женщин, из них в основную группу – 28 морфологически подтвержденных случаев ПЭ. При разделении ПЭ на подгруппы нами была принята рабочая классификация, по которой были определены 2 группы: аденоматозные (АП) – 11 случаев и фиброзно-железистые (ФЖП) – 17 случаев. В группу сравнения были отобраны 18 пациенток в постменопаузе (более 10 лет) без патологии эндометрия (контрольный эндометрий – КЭ), которым было проведено оперативное лечение по поводу пролапса гениталий. Критериями включения в группу с ПЭ были: постменопауза более 10 лет, наличие ПЭ на фоне атрофичного эндометрия. Критерии включения в группу без ПЭ: постменопауза более 10 лет, атрофичный эндометрий. Критериями исключения для всех групп были: прием гормонально активных препаратов (ЗГТ, тамоксифен) в анамнезе, прием НПВС в течение последних 6 месяцев, гиперплазия эндометрия, аденокарцинома эндометрия, сопутствующие миома матки и аденомиоз, хронический эндометрит, опухоли яичников.
На I этапе исследования был проведен анализ акушерского, гинекологического и соматического здоровья пациенток с ПЭ. Всем пациенткам с подозрением на ПЭ проводилась диагностическая гистероскопия по общепринятой методике [15], далее, при подтверждении диагноза, проводилось гистеророрезектоскопическое локальное удаление ПЭ, биопсия окружающего эндометрия и раздельное диагностическое выскабливание полости матки и цервикального канала.
Далее было проведено иммуногистохимическое (ИГХ) исследование полипов и образцов эндометрия. Иммуногистохимические реакции проводились на серийных парафиновых срезах толщиной 4 мкм, расположенных на стеклах, покрытых L-полизином. Демаскировка антигенов для ИГХ проводилась в ретривере с использованием цитратного буфера (рН 6,0) и при мощности 600 Вт. В качестве первичных антител применялись моноклональные и поликлональные антитела к ApoCas (Novocastra, Великобритания), Ki-67 (клон MIB-1, DAKO, Дания), VEGF-А (Abbiotec, США), PTEN (клон pS380, Epitomics, США), p16INK4a (клон R1473, AbCam, Великобритания). В качестве вторичных антител использовали наборы Dako REALTM EnVisionTM Detection System, Peroxidase/DAB+, Rabbit/Mouse (Code K5007). Ставились положительные и отрицательные контрольные реакции. Отрицательный контроль был представлен срезами, которые подвергались стандартной процедуре иммуногистохимии, но без добавления первичных антител. Положительный контроль для каждого антитела выбирали в соответствии со спецификациями от фирмы производителя. Оценку экспрессии маркеров осуществляли путем подсчета процента окрашенных клеток на 3000 клеток одного типа.
Статистическая обработка проводилась с помощью SPSS17 Statistics 17.0. Статистический анализ проводился непараметрическим методом с помощью U-критерия Манна–Уитни. Для установления корреляции между структурными изменениями и уровнем экспрессии маркеров в паренхиме и строме использовался коэффициент линейной корреляции Пирсона. Критический уровень достоверности нулевой стат...












