Кардиология №4 / 2017
Субпопуляционный состав T-лимфоцитов CD4+ как фактор, способствующий прогрессированию атеросклероза сонных артерий
ФГБУ Российский кардиологический научно-производственный комплекс Минздрава РФ, Москва
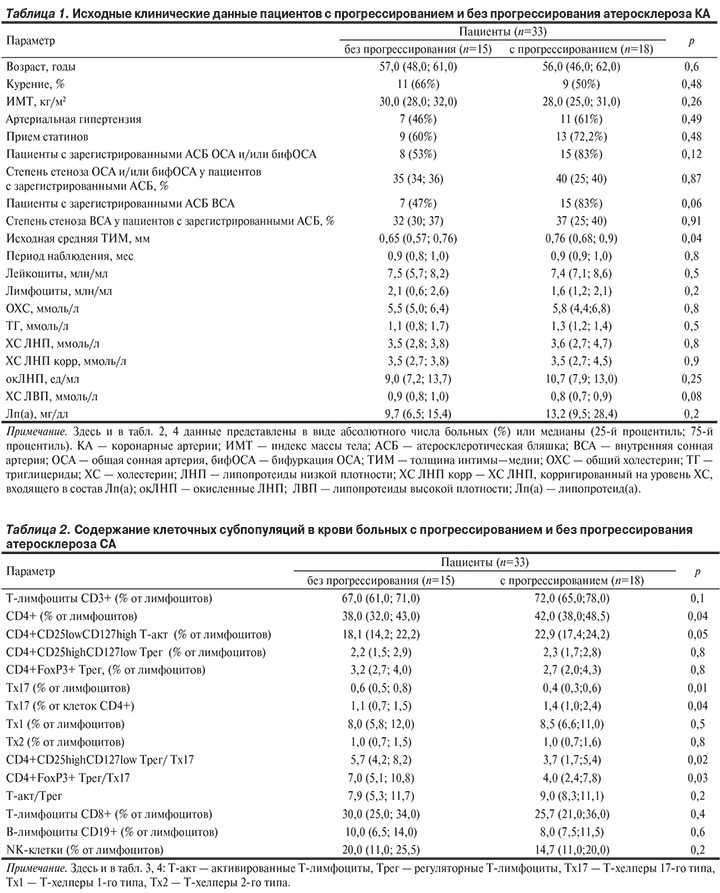
Цель исследования. Изучение прогностической значимости содержания в крови регуляторных и эффекторных Т-лимфоцитов в отношении прогрессии атеросклероза сонных артерий (СА). Материал и методы. В исследование были включены 33 пациента мужского пола с различной выраженностью атеросклероза СА. Ультразвуковое дуплексное сканирование экстракраниального отдела СА было выполнено дважды — при включении в исследование и спустя 1 год. Прогрессирование атеросклероза СА было определено как появление нового стеноза в общей и внутренней СА и/или увеличение степени имевшегося ранее стеноза на 5% и более. Иммунофенотипирование лимфоцитов крови, включающее определение CD4+IFNgamma+ Т-хелперов (Тх) 1-го типа, CD4+IL4+ Тх2, CD4+IL17+ Тх17, СD4+CD25lowCD127high активированных Т-клеток (Т-акт), СD4+CD25highCD127low и CD4+FoxP3+ регуляторных Т-лимфоцитов (Трег), было выполнено с помощью проточной цитофлуориметрии при включении в исследование. Результаты. Прогрессирование атеросклероза СА выявлено у 18 пациентов. У этих больных исходный уровень Tх17 был выше, а соотношение Трег/Тх17 ниже, чем у пациентов без прогрессирования атеросклероза СА. При ROC-анализе выявлено, что у больных с уровнем холестерина липопротеидов низкой плотности в крови менее 3,5 мМ содержания Тх17, Т-акт и отношение Трег/Тх17 обладали высокой чувствительностью и специфичностью в отношении прогрессии атеросклероза СА в течение года. Заключение. Дисбаланс между содержанием Трег и Тх17 с преобладанием провоспалительных Тх17 предрасполагает к прогрессированию атеросклероза СА, в том числе у больных, имеющих «целевые» уровни холестерина липопротеидов низкой плотности для пациентов из группы низкого риска.
Атеросклероз и связанные с ним заболевания занимают первое место как причина заболеваемости, потери трудоспособности, инвалидности и смертности населения большинства экономически развитых стран. Морфологической основой атеросклероза является воспаление, вызванное накоплением окисленных липопротеидов и других проатерогенных веществ в интиме артерии [1]. Данные вещества индуцируют экспрессию молекул адгезии, хемокинов, цитокинов и других медиаторов воспаления макрофагами и клетками сосудистой стенки, а также обладают свойствами аутоантигенов, активирующих клетки специфического иммунитета.
Лимфоциты CD4+ — основная популяция лимфоцитов, задействованных в атерогенезе. Вклад субпопуляций клеток CD4+ в развитие и течение атеросклероза неравнозначен. В многочисленных исследованиях на моделях атеросклероза у мышей с гиперлипидемией были доказаны проатерогенные эффекты Т-хелперов (Тх) 1-го типа и Тх17 и антиатерогенные эффекты регуляторных Т-лимфоцитов (Трег) [2—5]. Показана взаимосвязь иммунного дисбаланса с преобладанием воспалительного компонента (увеличенное содержание Тх17 и интерлейкина-17 в крови) у пациентов с атеросклерозом коронарных артерий (КА) и ишемической болезнью сердца [6, 7].
Изучению прогностической значимости иммунологических маркеров в прогрессировании атеросклероза у человека посвящены единичные исследования, и их данные противоречивы. В настоящем проспективном исследовании мы изучили связь показателей клеточного иммунитета с развитием атеросклероза сонных артерий (СА).
Материал и методы
Пациенты. С октября 2014 г. по февраль 2015 г. в исследование включены 40 пациентов в возрасте от 33 до 67 лет с различной выраженностью атеросклероза СА. Выбыли из исследования 7 пациентов в связи с недоступностью для контрольного обследования, исследование завершили 33 пациента.
В исследование не включали пациентов с инфарктом миокарда, острым нарушением мозгового кровообращения, хирургическими или эндоваскулярными вмешательствами в предшествующие 6 мес, злокачественными новообразованиями, тяжелой почечной или печеночной недостаточностью, с воспалительными/инфекционными заболеваниями, сахарным диабетом в стадии декомпенсации, а также пациентов, принимающих иммунотропные препараты.
Пациенты получали терапию согласно рекомендациям по ведению больных атеросклерозом периферических артерий [8]; за период наблюдения изменений терапии не проводилось.
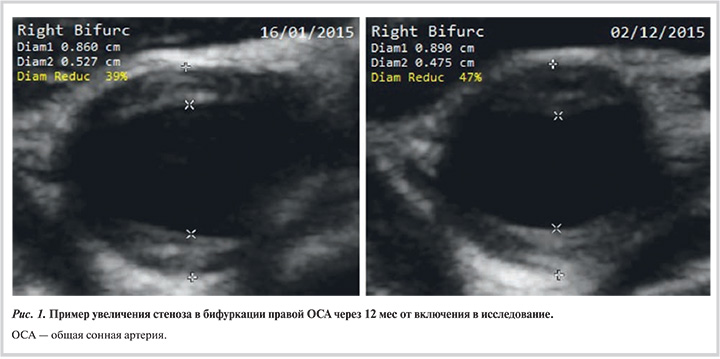
Ультразвуковое дуплексное сканирование (УЗДС) экстракраниального отдела брахиоцефальных артерий при включении в исследование и повторно (через 11—13 мес) проводили на ультразвуковой системе экспертного уровня Philips iU22 с помощью линейного датчика с частотой 9—3 МГц. Исследование выполняли в поперечном и продольном сечениях передним, латеральным и заднелатеральным доступом. Измерения проводили на всем протяжении визуализации общей сонной артерии (ОСА), внутренней сонной (ВСА) и наружной сонной артерий справа и слева. В анализ включали стенозы ОСА и ВСА. Определение толщины интимы—медии (ТИМ) и атеросклеротической бляшки (АСБ) проводили согласно данным Манхеймского консенсуса (2011) [9]. Среднюю ТИМ рассчитывали как среднее значение из максимальных значений ТИМ правой и ТИМ левой ОСА, измеренных передним и латеральным доступом. ТИМ >0,9 мм расценивали как утолщение интимы—медии. АСБ считали структуру, выступающую в просвет артерии более чем на 0,5 мм или на 50% от ТИМ соседних участков артериальной стенки, или увеличение ТИМ на 1,5 мм и более. Степень стеноза рассчитывали как отношение высоты АСБ к расстоянию между внешней границей медии противоположных стенок в зоне стеноза [10].
Критерием прогрессирования атеросклероза считали появление нового стеноза в ОСА и ВСА или увеличение степени стеноза на 5% и более.
Иммунофенотипирование лимфоцитов проводили при включении в исследование. Для выявления поверхностных антигенов использовали флуоресцентно меченные (–FITC, –PE, -PC5, –APC) моноклональные антитела к СD3, CD4, CD8, CD45, CD(16+56), CD19, CD5, CD23, CD25, CD27 (Becton Dickinson Immunocytometry Systems, eBioscience, BeckmanCoulter). Окрашивание поверхностных антигенов выполняли в цитратной крови c использованием растворов для лизиса эритроцитов и фиксации лейкоцитов (Becton Dickinson Immunocytometry Systems) и в культуре мононуклеарных лейкоцитов. Мононуклеарные клетки выделяли ...












