Урология №2 / 2017
Технические особенности кишечной пластики мочеточников. Часть 7: формирование мочекишечных анастомозов
Кафедра урологии Северо-Западного государственного медицинского университета им. И. И. Мечникова (зав. – проф. Б. К. Комяков), Санкт-Петербург, Россия; Городская многопрофильная больница № 2, отделение урологии, Санкт-Петербург, Россия
Цель: представить результаты и технические особенности формирования мочекишечных анастомозов при кишечной пластике мочеточников.
Материал и методы. В клинике урологии СЗГМУ им И.И. Мечникова заместительная пластика мочеточников кишечными сегментами выполняется с 1998 г. и к декабрю 2016 г. количество таких пациентов достигло 168. Средний возраст прооперированных составил 51±8,7 года. Мужчин было 76 (45,2%). У 119 (70,8%) пациентов кишечные сегменты использовались для замещения различных отделов мочеточников (подвздошная – у 92, толстая – у 4, червеобразный отросток – у 23), а у 49 (29,2%) уретеропластика сочеталась с ортотопической илеоцистопластикой. Изолированная пластика мочеточников сегментами тонкой и толстой кишки выполнена 96 пациентам.
Результаты. Среди 96 больных ранние послеоперационные осложнения возникли у 8 (8,3%) пациентов, 5 (5,2%) из которых потребовались повторные операции. Среди них у 2 (2,1%) человек имела место несостоятельность проксимальных анастомозов. В отдаленном послеоперационном периоде осложнения развились у 7 (7,3%) больных и 4 (4,2%) потребовалось оперативное лечение. У этих пациентов образовались стриктуры проксимальных мочеточниково-кишечных анастомозов спустя 3 мес и более после операции. Проходимость мочевыводящих путей была восстановлена путем антеградного бужирования стриктур. Пузырно-лоханочный рефлюкс имел место у 2 (2,1%) пациентов. Однако он не проявлялся клинически и не сопровождался гидроуретеронефрозом и рецидивирующей инфекцией мочевыводящих путей.
Заключение. Совершенный мочеточниково-кишечный анастомоз должен быть прост в создании, характеризоваться низким риском развития стеноза и препятствовать рефлюксу. Этим требованиям соответствует прямой анастомоз, сопряженный с минимальной вероятностью развития стриктуры, а при изоперистальтическом расположении и достаточной длине (не менее 15 см) трансплантата обеспечивает и антирефлюксную защиту. Следует отметить, что именно проксимальные (мочеточниково-кишечные) анастомозы являются уязвимыми местами при данных операциях, наиболее подверженными образованию стриктур. В отличие от проксимального дистальный анастомоз трансплантата с мочевым пузырем всегда является более широким, в связи с чем риск его сужения минимален. Отсутствие рефлюкса обеспечивается изоперистальтическим расположением трансплантата.
Введение. Важнейшим этапом при замещении мочеточника или мочевого пузыря кишечным сегментом является формирование мочекишечных анастомозов. Основное требование к создаваемому механизму отведения мочи – сохранение интактных верхних мочевых путей (ВМП) выше места оперативного вмешательства [1, 2]. В настоящее время не вызывает сомнений, что повторяющийся мочеточниково-лоханочный рефлюкс инфицированной мочи, равно как и гидроуретеронефроз, на фоне стриктуры мочеточника являются причиной нарастающего ухудшения функционального состояния ВМП и почек.
Несмотря на значительные успехи, достигнутые в реконструктивно-восстановительной хирургии мочевых путей, до сих пор существуют разногласия в том, является ли антирефлюксный механизм мочеточниково-кишечного анастомоза предпочтительным по сравнению с прямым методом имплантации [3].
В основе методов, позволяющих защищать верхние мочевые пути от ретроградного заброса мочи, лежат два физиологических принципа: ниппельный и клапанный. Первый заключается в создании инвагината (ниппеля) в месте имплантации мочеточника, который, выступая в просвет артифициального мочеточника и мочевого пузыря во время его заполнения, равномерно сдавливается мочой со всех сторон. Второй принцип также строится на законах гидравлики и заключается в формировании тоннеля для дистального участка мочеточника вдоль внутренней стенки трансплантата. В результате накапливающаяся моча сдавливает просвет мочеточника.
На сегодняшний день большинство авторов [4–7], принимая во внимание высокий риск развития стриктуры мочеточника вследствие формирования антирефлюксного механизма, считают лучшей технику прямого мочеточниково-кишечного анастомоза по методу Nesbit. Согласно представленным ими данным, частота стеноза при формировании прямого мочеточниково-кишечного анастомоза значительно ниже, однако в данном случае возрастает риск развития рефлюкса. U. Studer и соавт. [8] cообщают о хорошем функциональном результате использования длинной приводящей недетубуляризированной изоперистальтически расположенной кишечной петли. Их исследования показали, что динамический антирефлюксный механизм афферентного тубулярного сегмента при его достаточной длине надежно защищает ВМП после создания подвздошного резервуара низкого давления.
Материал и методы. В клинике урологии СЗГМУ им И. И. Мечникова заместительная пластика мочеточников кишечными сегментами выполняется с 1998 г., и к декабрю 2016 г. количество таких пациентов достигло 168. Средний возраст составил 51±8,7 года. Мужчин было 76 (45,2%), женщин – 92 (54,8%). У 119 (70,8%) пациентов кишечные сегменты использовались для замещения различных отделов мочеточников (подвздошная – у 92, толстая – у 4, червеобразный отросток – у 23), а у 49 (29,2%) человек уретеропластика сочеталась с ортотопической илеоцистопластикой. Изолированная пластика мочеточников сегментами тонкой и толстой кишки выполнена 96 пациентам. Всем больным проведено комплексное обследование, включившее ультразвуковые, рентгенологические, радиоизотопные и эндоскопические методы диагностики.
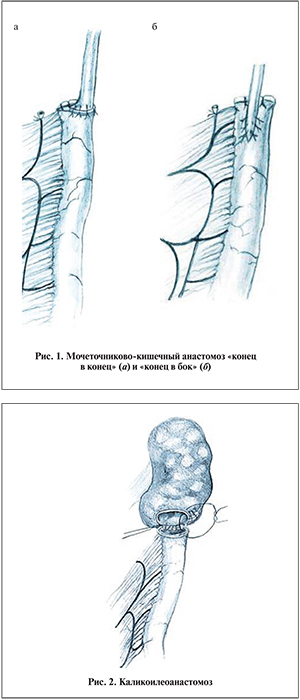 Проксимальные анастомозы можно подразделить на мочеточниково-кишечные, лоханочно-кишечные и чашечно-кишечные. Согласно нашим данным (n=96), их частота составила 89,6%; 9,3 и 1,1% соответственно. Большинство авторов полагают, что анастомоз должен прежде всего обеспечивать полную и свободную проходимость [1, 6, 9]. Мы также основываемся на этой точке зрения, поэтому выполняли прямые мочеточниково-кишечные анастомозы без антирефлюксных методик, по типу «конец в конец» (рис. 1, а) или «конец в бок», в обоих случаях спатулируя мочеточник, если он не расширен (рис. 1, б). Дополнительным и очень важным условием при этом считаем обязательное изоперистальтическое расположение кишечного трансплантата. При гидроуретеронефрозе мочеточниково-кишечный анастомоз чаще производили «конец в конец».
Проксимальные анастомозы можно подразделить на мочеточниково-кишечные, лоханочно-кишечные и чашечно-кишечные. Согласно нашим данным (n=96), их частота составила 89,6%; 9,3 и 1,1% соответственно. Большинство авторов полагают, что анастомоз должен прежде всего обеспечивать полную и свободную проходимость [1, 6, 9]. Мы также основываемся на этой точке зрения, поэтому выполняли прямые мочеточниково-кишечные анастомозы без антирефлюксных методик, по типу «конец в конец» (рис. 1, а) или «конец в бок», в обоих случаях спатулируя мочеточник, если он не расширен (рис. 1, б). Дополнительным и очень важным условием при этом считаем обязательное изоперистальтическое расположение кишечного трансплантата. При гидроуретеронефрозе мочеточниково-кишечный анастомоз чаще производили «конец в конец».
Значительно более сложным является вариант лоханочно-кишечного ана...












