Акушерство и Гинекология №4 / 2020
Технологические платформы преимплантационного генетического тестирования на анеуплоидии: сравнительная эффективность диагностики хромосомной патологии
1 ФГБНУ «Научно-исследовательский институт акушерства, гинекологии и репродуктологии им. Д.О. Отта» РАН, Санкт-Петербург, Россия;
2 ФГБУН «Институт физиологии им. И.П. Павлова», Санкт-Петербург, Россия;
3 Международный центр репродуктивной медицины, Санкт-Петербург, Россия;
4 СПб ГБУЗ «Городская больница №40», Санкт-Петербург, Россия;
5 Диагностический центр (медико-генетический), Санкт-Петербург, Россия;
6 ООО «Сербалаб», Санкт-Петербург, Россия;
7 Национальный медицинский исследовательский центр им. В.А. Алмазова;
8 Российский государственный педагогический университет им. А.И. Герцена, Санкт-Петербург, Россия;
9 ФГБОУ ВПО «Санкт-Петербургский государственный университет», Санкт-Петербург, Россия
Цель. Анализ спектра хромосомной патологии у эмбрионов 5–6 дня развития с использованием методов aCGH и NGS в двух центрах вспомогательных репродуктивных технологий (ВРТ), сравнение результатов, полученных с использованием двух методов.
Материалы и методы. Исследованы образцы трофэктодермы 1041 эмбриона. Для aCGH использовали чипы G5963A производства Agilent, NGS проводили на аппарате Illumina MiSeq, используя набор для подготовки библиотек VeriSeq PGS kit (Illumina).
Результаты. Количество простых анеуплоидий начинает возрастать уже после 30 лет, а анеуплоидий по двум и более хромосомам – после 37. Методы aCGH и NGS в нашей выборке показали сходную эффективность для проведения преимплантационного генетического тестирования на анеуплоидии (ПГТ-А). Статистически значимые различия в частоте хромосомных аномалий между двумя центрами ВРТ отсутствуют.
Заключение. Снижение доли эмбрионов со сбалансированным хромосомным набором является важнейшим фактором, ограничивающим репродуктивные возможности экстракорпорального оплодотворения (ЭКО) пациенток старшего репродуктивного возраста. Методы aCGH и NGS имеют сходную эффективность для проведения ПГТ-А. Частота хромосомных аномалий разных типов не отличается у эмбрионов, полученных в двух участвовавших в исследовании центрах ЭКО.
Проведение преимплантационного генетического тестирования на анеуплоидии (ПГТ-А) в циклах ЭКО существенно увеличивает частоту имплантации, позволяет сократить время до наступления беременности (на 6 месяцев – 1 год) и более чем в три раза снизить риск потери беременности в I триместре [1, 2].
Современная версия ПГТ-А – тестирование по всем хромосомам – вошло в практику центров вспомогательных репродуктивных технологий (ВРТ) в 2012 г. с внедрением метода сравнительной геномной гибридизации (aCGH, Comparative Genomic Hybridisation on microarrays), а затем массивного параллельного секвенирования (чаще называемого секвенированием следующего поколения, NGS, Next Generation Sequencing). Данные методы имеют сопоставимую разрешающую способность и способны выявлять большинство типов известных хромосомных аномалий [3]. Считается, что преимуществом NGS является лучшая выявляемость мозаичных вариантов, в то время как некоторые платформы для aCGH имеют лучшую разрешающую способность при выявлении сегментных анеуплоидий [4, 5].
Уже после начала применения ранних версий преимплантационной диагностики (с использованием метода FISH на полярных тельцах и бластомерах эмбрионов 3 дня развития) было установлено, что существует выраженная зависимость частоты хромосомной патологии эмбрионов от возраста матери [6]. Доля анеуплоидных эмбрионов начинает увеличиваться уже после 30 лет, а вероятность получения эуплоидного эмбриона из собственных яйцеклеток у пациенток 43 лет и старше не превышает 10% [7, 8]. Согласно рекомендациям PGDIS, возраст женщины старше 35 лет является ведущей причиной назначения ПГТ-А.
Настоящая работа посвящена анализу спектра хромосомной патологии, выявляемой в трофэктодерме эмбрионов 5 дня развития с использованием методов aCGH и NGS в отделении ВРТ НИИ АГиР им. Д.О. Отта и в Международном центре репродуктивной медицины (МЦРМ, Санкт-Петербург), сравнению этих методов и оценке возможного влияния разных эмбриологических протоколов на частоту хромосомных аномалий у эмбрионов.
Материалы и методы
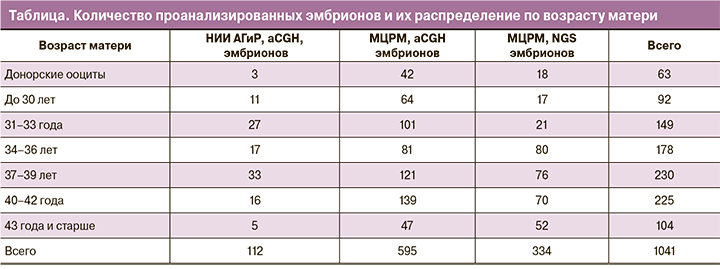
Материалом исследования являлись образцы биоптатов трофэктодермы эмбрионов 5 дня развития, полученные в ходе циклов ЭКО, проводимых в отделении ВРТ НИИ АГиР им. Д.О. Отта и в клинике МЦРМ. Всего в исследование был включен 1041 эмбрион, полученный от 420 пациенток, более подробная информация о распределении пациенток по возрасту приведена в таблице. Донорами ооцитов были женщины 22–28 лет. Критерием исключения являлось выявленное носительство структурных перестроек и маркерных хромосом у одного из родителей. Исследование одобрено Этическим комитетом НИИ АГиР им. Д.О. Отта. Все пациентки подписали информированное согласие на проведение исследования и обработку персональных данных, включая данные историй болезни.
Культивирование и биопсия эмбрионов, МЦРМ. Эмбрионы оплодотворяли методом ЭКО или ИКСИ в зависимости от качества эякулята и культивировали согласно описанному ранее протоколу [9]. Через 16–18 ч после оплодотворения проводилась визуальная качественная оценка пронуклеусов и полярных телец, после чего эмбрионы культивировали на средах COOK 5–6 дней до формирования бластоист. Морфологическая оценка бластоцист проводилась на основании классификации Гарднера [10, 11]. Д...












