Акушерство и Гинекология №9 / 2018
Трансдермальные эстрогены в программах вспомогательных репродуктивных технологий
ФГБУ Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова Минздрава России, Москва
В статье приведены исторические данные о применении эстрогенов в гинекологии. Показано, что преимуществами трансдермальных форм являются постоянная скорость высвобождения и всасывания действующего вещества, обеспечивающие минимальную вариабельность его концентраций в системном кровотоке, большая биодоступность, а также отсутствие влияния на желудочно-кишечный тракт и метаболический профиль. Проведен анализ современных данных по применению трансдермальных эстрогенов в программах вспомогательных репродуктивных технологий в наиболее частых клинических сценариях: переносе донорских ооцитов/эмбрионов, переносе криоконсервированных эмбрионов у пациенток с ановуляцией или истощением яичников и при «тонком» эндометрии.
Гормональная поддержка препаратами половых стероидных гормонов – неотъемлемая составляющая программ вспомогательных репродуктивных технологий (ВРТ). Обязательным минимумом гормональной поддержки в тех циклах, где проводится перенос эмбрионов (ПЭ), являются препараты прогестерона, обеспечивающие сохранение функции желтого тела и секреторную трансформацию эндометрия и тем самым создающие условия для имплантации эмбриона [1]. Однако залогом успешной секреторной трансформации эндометрия является его адекватная пролиферация в фолликулиновую фазу цикла под действием эстрогенов [2].
На сегодняшний день именно стимуляция пролиферации эндометрия является наиболее частой целью применения эстрогенов в программах ВРТ. Экзогенная поддержка эстрогенами используется в циклах с переносом донорских ооцитов или эмбрионов, переноса криоконсервированных эмбрионов у пациенток с ановуляцией или истощением яичников и при «тонком» эндометрии [3]. Целью данного мини-обзора является описание современной доказательной базы по применению трансдермальных эстрогенов в программах ВРТ с акцентом на трансдермальный гель с концентрацией 17β-эстрадиола 0,06%*.
Пути введения эстрогенов: преимущества и недостатки
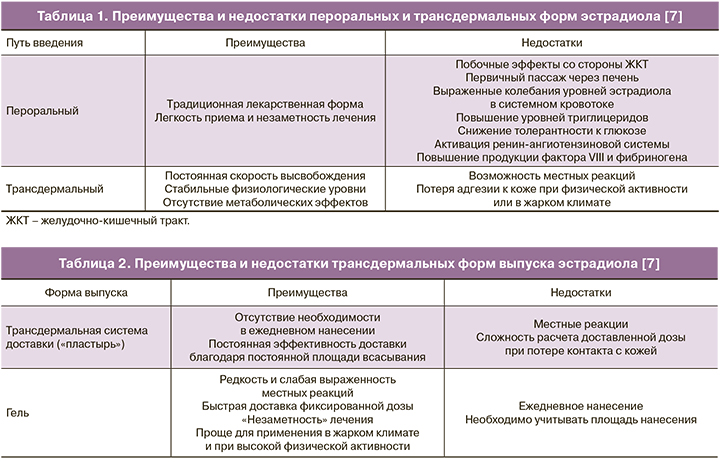
Препараты эстрадиола, зарегистрированные для применения в программах ВРТ, выпускаются в двух основных формах: пероральной и трансдермальной. Опыт применения пероральных эстрогенов в гинекологии составляет более 60 лет [4, 5]: эти препараты имеют хорошо изученный профиль эффективности и безопасности и, как любая пероральная форма, удобны для приема. Однако биодоступность эстрадиола при пероральном введении крайне невелика. Так, при приеме эстрадиола валерата до 97% действующего вещества при первичном пассаже через печень подвергается экстенсивному метаболизму до эстрона, эстриола и эстрона сульфата [6]. Низкая биодоступность перорального эстрадиола и его неблагоприятное влияние на липидный и углеводный обмен и коагуляционное звено гемостаза послужили предпосылкой для разработки новых путей введения [7].
Трансдермальные препараты эстрадиола выпускаются в форме трансдермальных систем доставки (пластырей) и водно-спиртовых гелей [8]. При контакте фазы-носителя с кожей эстрадиол быстро проникает в роговой слой эпидермиса и образует депо, из которого он постепенно поступает в системный кровоток [9, 10]. Ввиду того, что эпидермис играет роль барьера, всасывание эстрадиола из рогового слоя протекает согласно кинетике нулевого порядка: за единицу времени в кровоток поступает одно и то же количество действующего вещества, независимо от его концентрации [7].
Таким образом, преимуществами трансдермальных форм являются постоянная скорость высвобождения и всасывания действующего вещества, обеспечивающие минимальную вариабельность его концентраций в системном кровотоке, большая биодоступность, а также отсутствие влияния на желудочно-кишечный тракт и метаболический профиль [7, 9] (табл. 1).
Фармакокинетика и фармакодинамика эстрадиола при доставке в системный кровоток из трансдермальной системы или водно-спиртового геля существенно не различаются [11–13]. Таким образом, при выборе трансдермальной формы эстрадиола на первое место выходит индивидуальная переносимость и удобство лечения. В отличие от трансдермальных систем доставки, гели должны наноситься ежедневно, однако они реже вызывают местные реакции, особенно при длительном применении (табл. 2).
Основным источником прямых сравнительных данных по переносимости длительного применения различных трансдермальных форм эстрогенов являются исследования заместительной гормональной терапии у женщин в менопаузе. Так, в исследовании Hirvonen и соавт. (1997), местные реакции у пациенток, получавших эстрадиол в форме геля в течение одного года, наблюдались лишь в 3,3% случаев, по сравнению с 46,7% в группе использовавших трансдермальную систему доставки (пластырь). Единственной местной реакцией при использовании геля являлся слабый преходящий кожный зуд, в то время как применение пластыря сопровождалось стойким зудом и покраснением, а в редких случаях – отеком и шелушением кожи [14]. Сходные результаты были получены в исследовании Travassos de Figueiredo и соавт. (2000), сравнивавшем эффективность и переносимость трансдермального












