Урология №1 / 2014
Трехлетние результаты лечения локализованного рака простаты высокоинтенсивным сфокусированным ультразвуком
Кафедра урологии ГБОУ ВПО «Саратовский государственный медицинский университет им. В. И. Разумовского» Минздрава РФ (ректор – д.м.н. В. М. Попков), НИИ фундаментальной и клинической уронефрологии, Саратов
Целью исследования стала оценка эффективности лечения рака простаты с использованием высокоинтенсивного сфокусированного ультразвука на основании клинических, лучевых, лабораторных данных, результатов морфометрического и иммуногистохимического исследования послеоперационных биоптатов простаты. Проведено 112 сеансов HIFU-аблации простаты 112 пациентам с локализованным раком предстательной железы. Среднее количество импульсов воздействия – 634±176, средний объем тканей, подвергнутых воздействию, – 34,6±15,2 см³ за 1 процедуру. Продолжительность операции варьировалась от 90 до 165 мин (в среднем 125 мин) Послеоперационный койко-день колебался от 7 до 14 дней и в среднем составил 10,0±0,8 дня. Интраоперационных осложнений во время HIFU-аблации отмечено не было. Средний уровень простатспецифического антигена через 1,5 мес после операции составил 0,7 (0,12–3,67) нг/мл.
Минимальный его уровень достигался через 20±2 нед после лечения и в среднем составлял 0,26±0,01 нг/мл. Через 6 мес объем простаты уменьшался в среднем на 49%, к 10–12-му месяцу соответствовал 6,5±2,2 см3. Морфологический анализ после лечения включал исследования со стандартной и иммуногистохимической окраской с помощью следующих антител: PCNA, Bcl2, AMACR, Е-кадгерин, ANDR. Безрецидивное течение отмечено у 96 (85,8%) больных. Рецидивы выявлены у 16 (14,2%) пациентов, при этом биохимическое прогрессирование – у 11 (9,82%). У 5 (4,46%) диагностирован местный рецидив (подтвержден морфологически).
Введение. В настоящее время среди возможных вариантов лечения локализованного рака предстательной железы (РПЖ) все большее значение приобретают малоинвазивные методики, одной из которых является высокоинтенсивная сфокусированная ультразвуковая аблация простаты (HIFU – High Intensity Focused Ultrasound). Данный способ лечения особенно актуален для больных пожилого и старческого возраста с отягощенным соматическим статусом, желающих получить эффективное лечение при сохранении достойного качества жизни [2–8]. В представленной работе мы хотели бы поделиться опытом выполнения подобных операций.
 Материалы и методы. В клинике урологии СГМУ им. В. И. Разумовского метод HIFU-аблации для лечения локализованного РПЖ применяется с февраля 2009 г. Результаты и эффективность лечения мы проанализировали у 112 больных морфологически доказанным по данным биопсии локализованным РПЖ. Средний возраст пациентов составил 66,3±5,83 года. В зрелом социально активном возрасте (до 60 лет) находилось 36,6% пациентов (41 человек), в пожилом и старческом возрасте – 63,4% (59 человек).
Материалы и методы. В клинике урологии СГМУ им. В. И. Разумовского метод HIFU-аблации для лечения локализованного РПЖ применяется с февраля 2009 г. Результаты и эффективность лечения мы проанализировали у 112 больных морфологически доказанным по данным биопсии локализованным РПЖ. Средний возраст пациентов составил 66,3±5,83 года. В зрелом социально активном возрасте (до 60 лет) находилось 36,6% пациентов (41 человек), в пожилом и старческом возрасте – 63,4% (59 человек).
Показания к HIFU-аблации: локализованный РПЖ (стадии Т1-Т2сN0M0) у пациентов, которым невозможно выполнить радикальную простатэктомию ввиду:
- Наличия противопоказаний.
- Соматически отягощенного фона.
- Если пациент после ознакомления со всеми вариантами лечения отказался от них и выбрал аблативную технологию.
- Градация опухоли по шкале Глисона в сумме не более 7 баллов.
- Низкий или умеренный онкологический риск по классификации А. D'Аmico (2003).
- Уровень простатспецифического антигена (ПСА) общей фракции до 20 нг/мл.
- Исходный объем простаты не более 50 см3.
- Подписанное информированное согласие на выполнение HIFU-аблации простаты.
Показания к HIFU-аблации: локализованный РПЖ (стадии Т1–Т2сN0M0) у пациентов, которым невозможно выполнить радикальную простатэктомию ввиду наличия противопоказаний, соматически отягощенного фона; отказ от предложенных вариантов лечения и выбор аблативной технологии; градация опухоли по шкале Глисона в сумме не более 7 баллов; низкий или умеренный онкологический риск по классификации А. D'Аmico (2003); уровень общего простатспецифического антигена (ПСА) менее 20 нг/мл; исходный объем простаты не более 50 см3. Все пациенты подписали информированное согласие на выполнение HIFU-аблации простаты.

Противопоказаниями являлись: утолщенная стенка прямой кишки (более 8 мм по данным трансректального УЗИ), наличие ректоуретральных фистул; наличие инородных тел между простатой и прямой кишкой (металлические клипсы и др.); объем ампулы прямой кишки менее 50 см3; отсут-ствие прямой кишки; наличие в предстательной железе кальцинатов размером более 1 см; аллергическая реакция на латекс.
Пациенты проходили стандартное клиническое обследование. Перед выполнением HIFU-аблации диагноз был морфологически верифицирован с помощью трансректальной мультифокальной биопсии под ультразвуковым наведением либо при патогистологическом исследовании ткани простаты, полученной при трансуретральной резекции. По результатам биопсии опухолевый процесс был выявлен в обеих долях простаты у 60% пациентов, в правой доле – у 10,8%, в левой – у 22,5%.
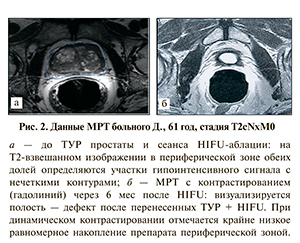 У 6,8% пациентов наличие злокачественной опухоли выявлено при трансуретральной резекции простаты (ТУРП), выполненной по поводу аденомы предстательной железы.
У 6,8% пациентов наличие злокачественной опухоли выявлено при трансуретральной резекции простаты (ТУРП), выполненной по поводу аденомы предстательной железы.
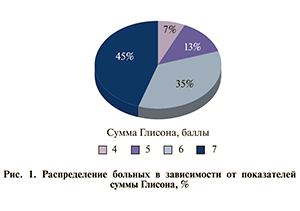
В ходе морфологического исследования биопсийного материала также произведена оценка степени дифференцировки опухолевых клеток. Наиболее часто встречались умеренно-дифференцированные опухоли (85,4 %), сумма баллов по шкале Глисона колебалась от 4 до 7 (рис. 1).
Для установления стадии заболевания на дооперационном этапе использована классификация ТNМ, редакция 2009 г. (табл. 1).
Средний уровень ПСА на дооперационном этапе – 9,6±3,4 нг/мл, Средний объем простаты – 33±7,7 см³.
По степени онкологического риска (по А. V. D'Аmico, 2003) больные распределены следующим образом:
Локализованный РП (T1–T2N0M0):
- низкий онкологический риск (Т1а–с, ПСА<10 нг/мл, Глисон <6) – 14 пациентов;
- умеренный риск (Т2а–с, ПСА 10–20 нг/мл, Глисон – 6–7) – 98 пациентов.
Методика проведения HIFU-аблации простаты. Сущность оперативного пособия заключается в воздействии на ткань предстательной железы сфокусированными ультразвуковыми волнами частотой 3 МГц. Операция выполняется в положении больного на правом боку под спинальной анестезией на специально оборудованном столе.
В прямую кишку вводится зонд-аппликатор, излучающий высокоинтенсивные, конвергирующие ультразвуковые волны. Последние абсорбируются на площади мишени, оказывая механическое в виде кавитации и термического воздействия и не повреждая тканей вне зоны излучения. В определенной...












