Фарматека №16 (269) / 2013
Управление липотоксичностью в дебюте сахарного диабета 2 типа
ГБОУ ДПО РМАПО, Москва
Стремительное распространение сахарного диабета и ожирения в мире требует незамедлительных мероприятий по изменению образа жизни и интервенции терапии начиная с ранних этапов развития заболевания, что позволит избегать дальнейшего развития нарушений углеводного и липидного обменов, а также их осложнений. По современным данным, патогенетическим связующим звеном данных заболеваний является липотоксичность, которая проявляется комплексом негативных эффектов жирных кислот на органы и ткани, вовлеченные в патогенез сахарного диабета. Проведенное исследование демонстрирует возможность успешного управления впервые выявленным сахарным диабетом 2 типа путем своевременного и эффективного влияния на массу тела под контролем параметров гликемического, липидного профилей и маркеров липотоксичности.
Введение
Важнейшими медицинскими, социальными и экономическими проблемами современности стали ожирение и сахарный диабет 2 типа (СД2). По данным 2013 г., СД2 имели 374 млн человек. Избыток массы тела или ожирение в настоящее время имеют 526 млн. Во многом именно за счет данной когорты пациентов к 2030 г. на Земле будет 552 млн больных СД [1]. Стремительное распространение СД и ожирения в мире во многом обусловлено сложившимся за последние десятилетия рационом питания, где превалируют легкоусвояемые углеводы и животные жиры. Ранее считалось, что данная проблема коснулась в основном США, где был изобретен и массово применяется фаст-фуд. Однако, по данным 2012 г., в Российской Федерации 46,5 % мужчин и 51,7 % женщин имеют ожирение или избыток массы тела, а СД страдают 9–10 млн человек [2, 3]. Следовательно, проблема нерационального питания и гиподинамии, приводящих к развитию нарушений углеводного обмена, требует незамедлительных мероприятий здравоохранения. Изменение образа жизни на раннем этапе позволит избегать дальнейшего развития СД2, его осложнений и сердечно-сосудистой патологии.
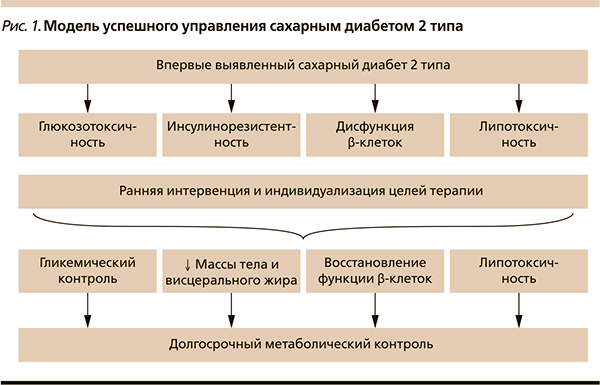
Для решения данных проблем в развитых странах мира разработаны алгоритмы, основной целью которых является достижение гликемического контроля, однако такой односторонний подход недостаточно эффективен. В исследованиях ACCORD, ADVANCE и VADT строгий гликемический контроль сопровождался увеличением риска смертности. Согласно результатам NHANES III (1988–1994), 44,5 % пациентов с СД2 имели уровень гликированного гемоглобина (HbA1c) < 7 %, а в период наблюдения 1999–2000 гг. – только 35,8 % [4]. Следовательно, существуют дополнительные патогенетические аспекты СД2, открывающие перед врачами «новое окно возможностей». По современным данным, таким механизмом остается липотоксичность – комплекс негативных эффектов жирных кислот (ЖК) на органы и ткани, вовлеченных в патогенез СД. Связующее звено нарушений углеводного и жирового обменов – липотоксичность – лежит в основе новой патогенетической концепции СД2: Diabetus Mellipidus.
Липотоксичность-связующее звено нарушений углеводного и жирового обмена
В нескольких исследованиях показана взаимосвязь висцерального ожирения, резистентности к инсулину и гипергликемии. Висцеральное ожирение также является независимым сильным предиктором развития СД2. Висцеральный жир более метаболически активен, чем подкожный, в нем с высокой скоростью происходят процессы липолиза или липогенеза, что, соответственно, делает его основным источником ЖК. Висцеральная жировая ткань имеет ограниченные возможности хранения энергии в виде ЖК, индивидуальные для каждого человека. При избыточном длительном употреблении в пищу легкоусвояемых углеводов и жиров жировая ткань накапливает лишнюю энергию, однако, когда наступает предел ее возможностей, ЖК начинают поступать в кровоток и затем – в нежировые органы и ткани, не предназначенные для их хранения [5]. Насыщение адипоцитов ЖК также сопровождается активацией патологических механизмов: образуются более крупные, резистентные к действию инсулина адипоциты; запускается процесс местного воспаления, стимулируется секреция провоспалительных цитокинов, что способствует развитию нечувствительных жировых клеток. В поджелудочной железе, печени и мышцах запускаются различные патологические процессы, в комплексе способствующие развитию нарушений углеводного обмена.
При воздействии высокой концентрации свободных жирных кислот (СЖК) на культуру β-клеток и изолированные островки Лангерганса подавляется первая фаза глюкозостимулированной секреции инсулина [6]. По данным С. Olofsson и соавт., длительное воздействие на островки глюкозы и СЖК ингибирует секрецию инсулина на поздней стадии экзоцитоза, влияя на высвобождение инсулина при слиянии пор [7]. Кроме того, пальмитиновая кислота способна ингибировать экспрессию гена SUR (sulfonylurea receptor)-1, что также может являться одним из молекулярных механизмов подавления глюкозостимулированной секреции инсулина [8].
Помимо процессов высвобождения инсулина под действием СЖК нарушается экспрессия гена инсулина. В эксперименте на изолированных островках Лангерганса воздействие пальмитиновой кислоты вызывало увеличение концентрации церамида, что было ассоциировано со снижением количества мРНК инсулина. G. Solinas и соавт. показали, что пальмитиновая кислота активирует JNK в β-клетках, что сопровождается фосфорилированием субстратов рецептора инсулина 1 и 2, нарушая транскрипцию гена инсулина [9]. Более того, СЖК активируют апоптоз β-клеток путем образования церамида и активации оксидативного стресса. Синтез церамидов в β-клетках увеличивает количество адаптивных нитратоксид-синтаз. Результирующее увеличение оксида азота увеличивает экспрессию воспалительных цитокинов, включая интерлейкин-1 и фактор некроза опухоли, которые ухудшают функцию β-клеток и способствуют их апоптозу. Негативные эффекты СЖК на поджелудочную железу могут лежать в основе нарастающего снижения массы β-клеток и прогрессирования СД2.
Влияние СЖК на печень характеризуется несколькими механизмами.
В первую очередь происходит активация глюконеогенеза. Увеличение поступления СЖК в печень сопровождается ускорением окисления липидов и накоплением ацетил-КоА, повышенная концентрация которого стимулирует активность пируваткарбоксилазы и тормозит скорость ферментов глюконеогенеза, а также глюкозо-6-фосфатазы, контролирующей скорость высвобождения глюкозы из гепатоцитов. Кроме того, в исследовании G. Boden и соавт. показана способность СЖК подавлять ингибирующий эффект инсулина на гликогенолиз.
У пациентов с СД2 увеличение концентрации СЖК в плазме сопровождается повышением плазменного уровня глюкагона и чувствительности печени к активации гликогенолиза [10]. Дополнительным негативным эф...
>











