Акушерство и Гинекология №10 / 2016
Уровень экспрессии гена кальмодулина в кумулюсных клетках как маркер наличия хромосомных аномалий в эмбрионах в программах экстракорпорального оплодотворения
ФГБУ Научный центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова Минздрава России, Москва
Цель исследования. Поиск молекулярно-генетических маркеров, ассоциированных с наличием хромосомных аномалий в эмбрионах, с целью оптимизации выбора переносимых эмбрионов для повышения эффективности программ ЭКО.
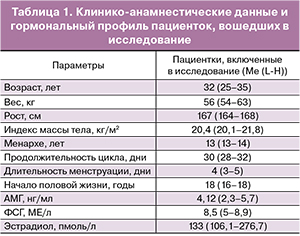
Материал и методы. Проанализированы 42 образца кумулюсных клеток от 11 пациенток, проходивших программу ЭКО (ИКСИ). Полученные эмбрионы разделялись на 4 группы: I группа – эмбрионы без хромосомных аномалий (20 образцов), II группа – эмбрионы с анеуплоидиями по половым хромосомам (3 образца), III группа – эмбрионы с анеуплоидиями по соматическим хромосомам (15 образцов), IV группа – гетероплоидные эмбрионы (4 образца). Был исследован уровень экспрессии мРНК 10 генов в кумулюсных клетках методом полимеразной цепной реакции с обратной транскрипцией в режиме реального времени: гиалуронан-синтетазы 2 (HAS2), простагландин синтетазы 2 (PTGS2), гремлина (GREM1), версикана (VCAN), инозитол-трифосфат 3 киназы А (ITPKA), молекулы клеточной адгезии активированных лейкоцитов (ALCAM или CD166), синдекан 4 (SDC4), кальмодулина (CALM2)), супрессора цитокиновой сигнализации, содержащий SPRY-домен (SPSB2)) и опухолевого протеина (TP53I3).
Результаты. Выявлена взаимосвязь между уровнем экспрессии мРНК генов СD166 (ALCAM), SDC4, VCAN и CALM2 и наличием хромосомной патологии эмбрионов (p=0,004, p=0,009, p=0,042, p=0,054 соответственно). По данным дискриминантного анализа уровень экспрессии мРНК гена CALM2 является наиболее информативным маркером наличия хромосомных аномалий в эмбрионах в программах ЭКО. Согласно проведенному исследованию, в группе эмбрионов плохого качества в 78,6% случаев встречаются хромосомные аномалии (ОШ=5,7 (1,4–23,9), р=0,023). Не было выявлено статистически значимых различий между уровнем экспрессии мРНК исследуемых генов и качеством развивающихся эмбрионов (p>0,05).
Заключение. Уровень экспрессии мРНК гена CALM2 является наиболее информативным маркером наличия хромосомных аномалий в эмбрионах в программах ЭКО. Однако необходимо дальнейшее изучение профиля экспрессии генов для поиска потенциальных биомаркеров в кумулюсных клетках с целью построения прогностической модели, с высокой достоверностью предсказывающей вероятность наличия хромосомных аномалий в эмбрионах. Данная математическая модель позволит в дальнейшем оптимизировать выбор переносимых эмбрионов и тем самым повысить результативность программ ЭКО в целом.
В настоящее время вспомогательные репродуктивные технологии широко применяются для лечения бесплодия, и с каждым годом увеличивается количество пациентов, проходящих лечение в программе ЭКО. Несмотря на постоянное совершенствование технологий в лечении бесплодия, эффективность программ ЭКО не превышает 30–35% [1].
Одним из основных способов улучшения результативности ЭКО является выбор эмбриона с высоким потенциалом к имплантации [2, 3]. В современной практике качество переносимых эмбрионов в основном оценивается согласно морфологическим критериям, включающим скорость, своевременность и равномерность деления клеток, форму бластомеров, степень их фрагментации и другие [4]. Однако информативность метода морфологического отбора эмбрионов не достаточно высока [5, 6].
В связи с этим возникает необходимость поиска новых критериев, определяющих качество эмбрионов и их потенциал к имплантации.
Известно, что одной из основных причин неудач имплантации может быть наличие хромосомной патологии у переносимых эмбрионов [7]. И хотя перенос эуплоидного эмбриона не является гарантией наступления беременности, он существенно повышает ее шансы, вплоть до 70–75% [8]. В связи с этим в последнее время в широкую практику входит применение молекулярных цитогенетических методов, которые позволяют оценить сбалансированность генома, например метод сравнительной геномной гибридизации (aCGH). Однако недостатком данного метода является высокая стоимость исследования, невозможность осуществить диагностику вследствие малого количества материала, риск повреждения эмбриона при биопсии бластомера или клеток трофоэктодермы, вероятность мозаицизма, а также невозможность исключить сбалансированные хромосомные аберрации и точечные мутации генов [9]. К неинвазивным методам оценки качества эмбрионов относят непрерывное наблюдение за их развитием (time-lapse embryo selection), а также протеомный анализ сред культивирования эмбрионов [10, 11]. Дальнейшее развитие малоинвазивных объективных методов оценки качества ооцитов и эмбрионов, позволяющих проводить селекцию эмбрионов с высоким потенциалом к имплантации и отсутствием хромосомных аномалий является одним из наиболее важных направлений репродуктивной медицины [12].
Достаточно многообещающе выглядят исследования последнего десятилетия, демонстрирующие возможность оценки качества ооцитов и эмбрионов по состоянию окружающих его клеток, получаемых при выделении кумулюсооцитарного комплекса после пункции фолликула [13–15].
Известно, что окружающие ооцит кумулюсные клетки образуются в процессе фолликулогенеза на этапе формирования полости внутри фолликула из низко дифференцированных предшественников – клеток гранулезы [16]. Кумулюсные клетки тесно связанны с ооцитом посредством специальных щелевых контактов, позволяющих осуществлять метаболический обмен и транспорт сигнальных молекул [17]. Таким образом, кумулюсные клетки оказывают непосредственное влияние на рост и развитие ооцита, регулируя его транскрипционную активность, а также ядерное и цитоплазматическое созревание [18, 19]. Важная роль кумулюсных клеток в оогенезе заставила ученых всего мира сосредоточиться на их исследовании [12, 20].
Доказано, что уровень экспрессии потенциально значимых генов в кумулюсных клетках коррелирует с показателями качества ооцитов и эмбрионов и частотой наступления беременности [14, 15, 21–23], а также обнаружена весомая связь с хромосомными аномалиями эмбрионов при проведении предимплантационной генетической диагностики [24]. Таким образом, оценка транскриптома кумулюсных клеток может стать новым дополнительным малоинвазивным методом прогнозирования наличия хромосомных аномалий у плода.
Цель исследования: поиск молекулярно-генетический маркеров, ассоциированных с вероятностью наличия хромосомных аномалий в эмбрионах, с целью оптимизации выбора переносимых эмбрионов для повышения эффективности программ ЭКО.
Материал и методы исследования
На базе отделения вспомогательных технологий в лечении бесплодия и лаборатории молекулярно-генетических методов ФГБУ Научный центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова Минздрава России проведено ретроспективное исследование случай-контроль.
 В кумулюсных клетках методом полимеразной цепной реакции с обратной транскрипцией в режиме реального времени был исследован уровень экспрессии мРНК 10 генов: генов внеклеточного матрикса (гиалуронан-синтетаза 2 (HAS2), версикан (VCAN), молекула клеточной адгезии активированных лейкоцитов (ALCAM или CD166)), генов, регулирующих передачу внутриклеточной информации (простагландин синтетаза 2 (PTGS2), гремлин (GREM1), инозитол-трифосфат 3 киназа А (ITPKA), синдекан 4 (SDC4), кальмодулин (CALM2)), а также гена, регулирующего убиквитинирование (супрессор цитокиновой сигнализации, содержащий SPRY-домен (SPSB2)) и гена опухолевого протеина (TP53I3) (реактивы ДНК-Технология, Россия).
В кумулюсных клетках методом полимеразной цепной реакции с обратной транскрипцией в режиме реального времени был исследован уровень экспрессии мРНК 10 генов: генов внеклеточного матрикса (гиалуронан-синтетаза 2 (HAS2), версикан (VCAN), молекула клеточной адгезии активированных лейкоцитов (ALCAM или CD166)), генов, регулирующих передачу внутриклеточной информации (простагландин синтетаза 2 (PTGS2), гремлин (GREM1), инозитол-трифосфат 3 киназа А (ITPKA), синдекан 4 (SDC4), кальмодулин (CALM2)), а также гена, регулирующего убиквитинирование (супрессор цитокиновой сигнализации, содержащий SPRY-домен (SPSB2)) и гена опухолевого протеина (TP53I3) (реактивы ДНК-Технология, Россия).












