Кардиология №6 / 2017
Уровень эозинофильного катионного белка у пациентов с ишемической болезнью сердца и стентированием коронарных артерий
ФГБУ Российский кардиологический научно-производственный комплекс Минздрава РФ, Москва
Одним из основных направлений в лечении больных с различными формами ишемической болезни сердца (ИБС) являются эндоваскулярные процедуры, в частности стентирование коронарных артерий (КА). Появление стентов с лекарственным покрытием (СЛП) привело к значительному снижению частоты развития рестеноза в них в первый год наблюдения [1]. Несмотря на обнадеживающие результаты, полученные в ходе начальных исследований по оценке безопасности и эффективности СЛП первого поколения (покрытие сиролимусом и паклитакселем), в дальнейшем было отмечено, что в них тоже развивается рестеноз, но в более поздние сроки. Некоторые исследователи полагают, что антипролиферативные вещества, покрывающие стент, снижают риск развития рестеноза, но не предотвращают его, что и послужило причиной дальнейших исследований в этом направлении [2].
В ряде работ было показано, что концентрация маркеров воспаления до стентирования, а также в различные сроки после него может иметь связь с развитием рестеноза [3, 4]. Так, повышенный уровень С-реактивного белка (СРБ) и скорость оседания эритроцитов (СОЭ) являются неблагоприятными прогностическими факторами в отношении развития рестеноза после имплантации СЛП [5].
S. Yoneda и соавт. [6] было показано, что состав неоинтимы, сформированной после имплантации СЛП, отличается от такового после имплантации металлических стентов без лекарственного покрытия (МС). Количество гладких мышечных клеток в первом случае существенно меньше, при этом отмечается повышенная инфильтрация эозинофилами, макрофагами и Т-лимфоцитами. Возможно, это вызвано наличием полимера — базисного слоя, служащего резервуаром для постепенно высвобождающегося лекарственного препарата и равномерного распределения концентрации вещества в окружающих тканях в течение длительного времени.
 Развитие рестеноза — многофакторный процесс со сложными механизмами, в которые могут быть вовлечены разные типы клеток иммунной системы. Предполагают, что одним из возможных компонентов в патогенезе развития атеросклероза КА и рестеноза является эозинофильное воспаление. Так, в работе N. Giampaolo и соавт. [7] сделано предположение, что исходно повышенный уровень эозинофильного катионного белка (ЭКБ) — маркера активности эозинофилов – может быть прогностическим фактором сердечно-сосудистых осложнений после имплантации СЛП.
Развитие рестеноза — многофакторный процесс со сложными механизмами, в которые могут быть вовлечены разные типы клеток иммунной системы. Предполагают, что одним из возможных компонентов в патогенезе развития атеросклероза КА и рестеноза является эозинофильное воспаление. Так, в работе N. Giampaolo и соавт. [7] сделано предположение, что исходно повышенный уровень эозинофильного катионного белка (ЭКБ) — маркера активности эозинофилов – может быть прогностическим фактором сердечно-сосудистых осложнений после имплантации СЛП.
Цель данной работы — определить уровни ЭКБ и высокочувствительного С-реактивного белка (вч-СРБ) в сыворотке крови у пациентов с ИБС и сопоставить с тяжестью атеросклеротического поражения КА, а также оценить динамику уровня этих показателей после чрескожного коронарного вмешательства (ЧКВ).
Материал и методы
Критерием включения в исследование было наличие показаний к проведению коронарографии (КГ). В исследование не были включены пациенты с аллергическими реакциями или хроническими заболеваниями аллергической природы, а также с тяжелыми сопутствующими патологиями.
Всем включенным в исследование больным помимо стандартного лабораторного и инструментального обследования проводилось определение уровня вч-СРБ и ЭКБ в сыворотке крови. Все показатели были определены исходно (за 24 ч до КГ) и на 3-и сутки после процедуры.
Кровь для исследования брали из локтевой вены пациентов утром натощак в пробирки с активатором свертывания (каолин). Образцы крови для определения уровня ЭКБ подвергали инкубации (2 ч при температуре 25 оС), затем их центрифугировали в течение 10 мин при 1500 об/мин. После этого образцы сыворотки крови замораживали и хранили при температуре –70 оС. Уровень ЭКБ определяли иммуноферментным методом на автоматическом хемилюминесцентном анализаторе Immulite-1000. Уровень вч-СРБ определяли высокочувствительным нефелометрическим методом на автоматическом лазерном нефелометре BN-proSpec.
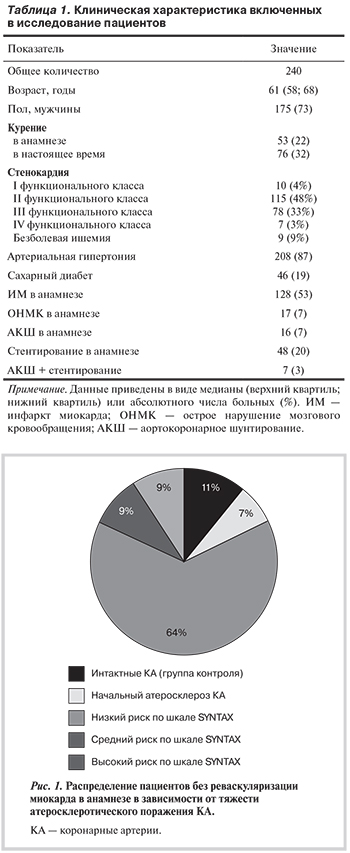
Гемодинамически значимым считали атеросклеротическое поражение коронарного русла, сужающего просвет артерии на 70% и более. В случаях стенозирования ствола левой КА гемодинамически значимым считали сужение просвета более 50%. Тяжесть атеросклеротического поражения определяли по шкале SYNTAX, которая используется для определения оптимальной стратегии хирургического лечения. К категории низкого риска относятся пациенты с суммой баллов от 0 до 22; среднего риска — от 23 до 32 баллов; высокого риска — ≥33 баллов.
Рестенозом считали атеросклеротическое поражение ранее стентированного участка (внутри стента и на 5 мм пр...












