Урология №3 / 2017
Вирус папилломы человека высокого онкогенного риска и рак мочевого пузыря
ˡ Кафедра урологии и хирургической андрологии РМАНПО (зав. каф. – академик РАН, д.м.н., проф. О. Б. Лоран), Москва, Россия; 2 урологическое отделение и 3патологоанатомическое отделение ГБУЗ ГКБ № 68 ДЗМ
(гл. врач – д.м.н., проф. С. Н. Переходов), Москва, Россия; 4 Коми республиканский онкологический диспансер (КРОД) (гл. врач – А. Н. Соколов), Сыктывкар, Россия; 5 Вологодская областная клиническая больница № 2 (ВОКБ № 2)
(гл. врач – д.м.н. А. Г. Пулин), г. Череповец, Россия
Цель: определить роль вируса папилломы человека (ВПЧ) высокого онкогенного риска в развитии рака мочевого пузыря.
Материалы и методы. Проведено обследование и лечение 100 пациентов (72 мужчины и 28 женщин) в возрасте от 38 до 90 лет (средний возраст – 65±10 лет) c диагнозом «рак мочевого пузыря». Дополнительно выполнены иммуноферментные анализы крови на наличие противовирусных антител к вирусу простого герпеса (ВПГ) 1-го и 2-го типов, цитомегаловирусу (ЦМВ), вирусу Эпштейна–Барр (ВЭБ); соскоб из уретры для выявления ВПЧ высокого онкогенного риска. Осуществляли забор ткани опухоли с целью выявления вышеуказанных вирусов методом ПЦР. Полуколичественно оценивали составляющие лимфоцитарно-плазмоцитарного и лейкоцитарного инфильтратов, цитопатические изменения опухолевой ткани.
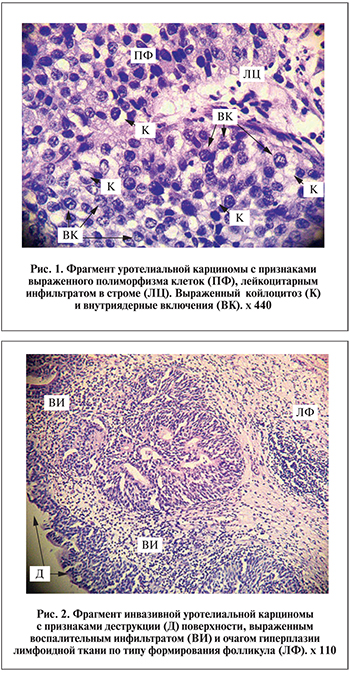
Результаты. Были выявлены прямые коррелятивные связи между цитопатическими изменениями клеток (койлоцитозом и внутриядерными включениями как проявлениями ВПЧ) и уровнем противовирусных антител, наличием вирусов в опухоли, а также составляющими лимфоидно-плазмоцитарного инфильтрата. И обратные – между наличием папилломатоза и вышеуказанными изменениями.
Заключение. Вирус папилломы человека рассматривается как триггер возникновения опухоли у пациентов молодого возраста на фоне латентной инфекции (ЦМВ и ВЭБ, ВПГ, ВПЧ). Цитопатические изменения (койлоцитоз и внутриядерные включения) были ассоциированы с активностью и морфологическими признаками герпес-вирусных инфекций. Их степень варьировалась в зависимости от стадии процесса, но не от степени анаплазии. Папилломатоз ассоциирован с более благоприятным течением опухолевого процесса.
Введение. В настоящее время этиологическая роль высокоонкогенных типов вируса папилломы человека (ВПЧ) при плоскоклеточном раке шейки матки и верхних дыхательных путей считается доказанной. Вместе с тем появились публикации, указывающие на влияние ВПЧ на возникновение РМП, однако данные их весьма противоречивы [1–3]. Что касается ВПЧ высокого онкогенного риска, то все больше исследователей склоняются к причастности вируса к развитию рецидивных форм РМП [2] и появлению инвазивных и низкодифференцированных его форм [4]. Кроме того, Д. А. Головина и соавт. [5] указывают на изменения уротелия вокруг опухоли (микроокружения) вирусом папилломы человека и вовлечение нормального эпителия в онкопроцесс с развитием рецидивных форм опухоли уже в отсутствие вируса [5]. T. Griffiths и соавт. [6] сделали вывод, согласно которому вирус играет определенную роль в канцерогенезе у иммунокомпрометированных пациентов, тогда как у пациентов с нормальным уровнем иммунной защиты ВПЧ в развитии уротелиальной опухоли мочевого пузыря роли не играет [6].
Цель исследования: определить роль ВПЧ высокого онкогенного риска в развитии РМП.
Материалы и методы. Проведено обследование и лечение 100 больных (72 мужчины и 28 женщин) в возрасте от 38 до 90 лет (средний возраст – 65±10 лет), поступивших в стационар с направительным диагнозом «рак мочевого пузыря». Дополнительно к общепринятым методам обследования взяты анализы крови на IgG, M к вирусу простого герпеса (ВПГ) 1-го и 2-го типов (ВПГ-1 и ВПГ-2), цитомегаловирусу (ЦМВ), вирусу Эпштейна–Барр (ВЭБ). Ткань опухоли и моча взяты на ПЦР-диагностику с целью выявления вирусов ВПГ-1 и ВПГ-2, ВПЧ высокого онкогенного риска (16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66, 68), ЦМВ, ВЭБ. Было исследовано и проанализировано 100 гистологических случаев с эпителиальными злокачественными образованиями мочевого пузыря. Операционный и биопсийный материалы фиксировались в 10%-ном растворе формалина, использовался метод спиртовой проводки с последующей заливкой в парафин. В микропрепаратах, представляющих собой парафиновые срезы, окрашенные гематоксилин-эозином, оценивалась степень анаплазии и мышечной инвазии.
Семидесяти больным была проведена оценка воспалительной инфильтрации в опухолевой ткани и подлежащей строме.

Полуколичественно от 0 до 3 баллов (отсутствие, слабая, умеренная и выраженная степени) оценивались следующие признаки:
- Лимфоцитарно-плазмоцитарный инфильтрат: а) в опухоли, б) рассеянный в подлежащей строме, в) периваскулярная инфильтрация, г) очаговая гиперплазия лимфоидной ткани в виде лимфоидных фолликулов.
- Активность воспаления: а) степень лейкоцитарного инфильтрата, б) степень эозинофильной инфильтрации.
- Цитопатические изменения: а) внутриклеточные включения (койлоцитоз), б) внутриядерные включения.
 В работе использованы общепринятые методы статистической обработки данных – все числовые показатели проверялись на соответствие нормальному закону распределения с помощью критерия Лиллиефорса, определены средние значения (M), стандартное отклонение (SD), ошибка среднего (m), в работе данные представлены как M±m, 95% доверительный интервал, частоты (%). Различия между количественными показателями осуществлялись с помощью t-критерия Стьюдента для независимых выборок или непараметрического U-критерия Манна–Уитни. Различия между частотой признаков находились с помощью критерия χ2, точного критерия Фишера. Для малых выборок, для случаев частоты, равной 0% или 100%, использовался t-критерий Стьюдента для частот с поправкой на концевые точки. Для определения связи между изучаемыми параметрами применен корреляционный анализ Пирсона (r) или Спирмена (R). Статистически значимыми принимались различия при p<0,05.
В работе использованы общепринятые методы статистической обработки данных – все числовые показатели проверялись на соответствие нормальному закону распределения с помощью критерия Лиллиефорса, определены средние значения (M), стандартное отклонение (SD), ошибка среднего (m), в работе данные представлены как M±m, 95% доверительный интервал, частоты (%). Различия между количественными показателями осуществлялись с помощью t-критерия Стьюдента для независимых выборок или непараметрического U-критерия Манна–Уитни. Различия между частотой признаков находились с помощью критерия χ2, точного критерия Фишера. Для малых выборок, для случаев частоты, равной 0% или 100%, использовался t-критерий Стьюдента для частот с поправкой на концевые точки. Для определения связи между изучаемыми параметрами применен корреляционный анализ Пирсона (r) или Спирмена (R). Статистически значимыми принимались различия при p<0,05.
Результаты. Стадия процесса соответствовала T1NxM0 для 51 больного, в 1 случае имела место папиллома мочевого пузыря, T2NxM0 у 25 больных, в 23% случаев выявлен местнораспространенный процесс. У 7 пациентов диагностировано лимфогенное метастазирование. Трансуретральная резекция стенки мочевого пузыря с опухолью выполнена 70 больным, радикальная цистэктомия с формированием гетеротопического резервуара (уретерокутанеостомией в двух случаях и в ряде случаев с сигмостомией) – 16, резекция мочевого пузыря – 14 пациентам. Опухоль была рецидивой для 24 пациентов.
Вирусные ДНК в опухолевой ткани были выявлены у 34 пациентов (21 мужчина и 13 женщин). Инфицирование ткани ВЭБ имело место в 27 случаях, ЦМВ – в 6, ВПЧ высокого онкогенного риска (16, 39, 45, 52, 59) – в 5, ВПГ-1 и ВПГ-2 – в 1. В 4 наблюдениях выявлена ДНК нескольких вирусов: ВПЧ+ВЭБ (1), ВЭБ+ЦМВ (2), ЦМВ+ВЭБ+ВПЧ (1). Опухоли являлись низкодифференцированными в 56% случаев.
Результаты морфологического исследования образцов тканей представлены в табл. 1. По степени анаплазии пациенты распределились следующим образом: уротелиальная карцинома высокой степени злокачественност...












