Кардиология №8 / 2014
Влияние аторвастатина на провоспалительный статус (in vivo и in vitro) больных гипертонической болезнью с метаболическим синдромом
ГБОУ ВПО «Сибирский государственный медицинский университет» Минздрава РФ, 634050 Томск, ул. Московский тракт, 2; МУЗ Томская центральная районная больница
Цель исследования — изучение влияния аторвастатина на спонтанную продукцию цитокинов и активных форм кислорода (АФК)
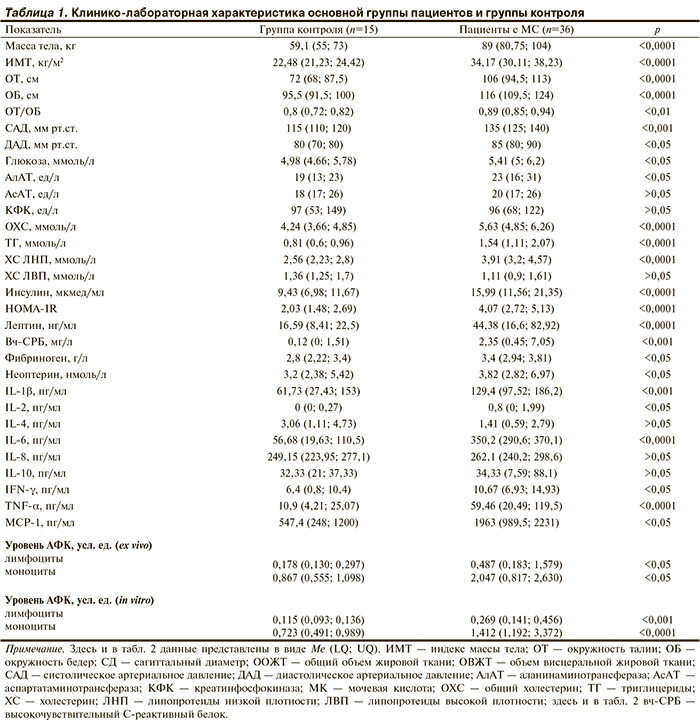
мононуклеарными лейкоцитами крови у больных гипертонической болезнью (ГБ) с метаболическим синдромом (МС) in vivo и in vitro. Проведено 8-недельное открытое проспективное исследование, в которое включили 36 пациентов с ГБ II стадии, ассоциированной с МС. Наряду с обследованием, принятым в специализированной кардиологической клинике, проводили оценку спонтанной продукции цитокинов, АФК мононуклеарными лейкоцитами крови в ходе терапии аторвастатином in vivo. Оценивали также динамику этих показателей при воздействии аторвастатина на взвесь мононуклеарных лейкоцитов in vitro. Установлено, что 8-недельная терапия аторвастатином у пациентов с ГБ II стадии в сочетании с МС в индивидуально подобранных дозах (от 20
до 40 мг/сут) способствует уменьшению концентрации белков острой фазы (С-реактивного белка и неоптерина) в сыворотке крови и уменьшению спонтанной продукции мононуклеарными лейкоцитами крови ряда провоспалительных цитокинов (IL-1β, IL-6 и TNF-α)
и ФК. Динамика концентраций цитокинов в супернатантах мононуклеарных лейкоцитов, полученных после инкубации клеток
с аторвастатином in vitro, подтверждает предположение о непосредственном ингибирующем влиянии этого препарата на спонтанную продукцию некоторых провоспалительных цитокинов (IL-6 и MCP-1). Отсутствие значимого снижения концентраций других провоспалительных цитокинов (IL-1β и TNF-α) и экспрессии АФК в условиях in vitro свидетельствует о сложном опосредованном влиянии терапии аторвастатином на их продукцию.
Актуальную медико-социальную проблему представляет собой метаболический синдром (МС) — кластер модифицируемых факторов риска развития и тяжелого течения ряда социально значимых заболеваний, основных причин высокой заболеваемости, инвалидизации и смертности современного человечества, способствующих также значительному снижению качества жизни (КЖ) [1–7]. В механизмах прогрессирования сосудистых и органных нарушений при МС и ассоциированных с ним заболеваний существенную роль играет воспаление [8, 9].
В исследованиях на популяционном уровне продемонстрирована статически значимая связь между маркерами системного воспаления в сыворотке крови и компонентами МС [2, 5, 8, 9]. Хорошо известно, что любой воспалительный процесс реализуется при участии иммунокомпетентных клеток, активированных различными повреждающими факторами и выделяющих биологически активные вещества (цитокины) и активные формы кислорода (АФК) [10]. В связи с этим ингибирование продукции цитокинов рассматривается как один из возможных подходов к лечению МС и ассоциированных с ним заболеваний.
Открытие противовоспалительных и иммуномодулирующих свойств ингибиторов 3-гидрокси-3-метилглутарил-коэнзим А-редуктазы (статинов) — группы препаратов, рекомендованных пациентам с заболеваниями, ассоциированными с МС, для коррекции дислипидемии, имеет большое значение для клинической медицины [11, 12]. При этом механизм их противовоспалительного действия изучен недостаточно.
Цель исследования: изучение влияния аторвастатина на спонтанную продукцию цитокинов и АФК мононуклеарными лейкоцитами крови in vivo и in vitro у больных гипертонической болезнью (ГБ) с МС.
Материал и методы
В 8-недельное открытое неконтролируемое исследование включили 36 пациентов с ГБ II стадии (ультразвуковые признаки утолщения стенки артерии или атеросклеротические бляшки магистральных сосудов выявлены у всех пациентов, увеличение массы миокарда левого желудочка — у 25 [13]), ассоциированной с МС. Среди них больше было женщин (n=28; 77,8%). Средний возраст пациентов составил 53,8±8,8 года. МС диагностирован на основании рекомендаций Всероссийского научного общества кардиологов по диагностике и лечению МС (второй пересмотр). Для этого определяли необходимый спектр клинических, лабораторных и инструментальных показателей, предусмотренный для пациентов такого профиля [6].
Все пациенты в течение различного времени (в зависимости от продолжительности ГБ) получали гипотензивную терапию в виде либо комбинации ингибитора ангиотензинпревращающего фермента и диуретика (n=25; 69,4%), либо блокаторов медленных кальциевых каналов и диуретика (n=11; 30,6%) в индивидуально подобранных дозах. В качестве диуретического средства всем пациентам был назначен индапамид, который существенно не влияет на метаболизм и показан пациентам такого профиля. При данной терапии целевой уровень артериального давления — АД (<130/85 мм рт.ст.) [13] был достигнут у большинства больных (n=30; 83,3%).
Всем больным после предварительного исследования назначали аторвастатин (липримар; «Pfizer Inc.», Нью-Йорк, США) в индивидуально подобранной дозе, достаточной для достижения целевого уровня липидов в крови, определяемого исходя из категории общего риска развития сердечно-сосудистых осложнений [14]. При этом дозу аторвастатина (от 20 до 40 мг/сут) определяли исходя из известной липидкорригирующей эффективности препарата, установленной в ходе клинического исследования STELLAR (Statin Therapies for Elevated Lipid Levels Compared Across Doses to Rosuvastatin) [15].
Все лица, принявшие участие в исследовании, подписали информированное согласие. Клиническое и лабораторное (оценка безопасности лечения включала определение в сыворотке крови активности трансаминаз и креатинфосфокиназы — КФК) обследование пациентов проводили дважды по специально разработанному протоколу (одобрен этическим комитетом ГБОУ ВПО Сибирский государственный медицинский университет Минздрава России; регистрационный № 1707): до и после 8-недельной терапии аторвастатином.
В исследование не включали лиц с симптоматической артериальной гипертензией, тяжелыми сопутствующими заболеваниями и заболеваниями воспалительной природы другой локализации, а также лиц, получающих липидкорригирующую терапию.
Группу контроля составили 12 здоровых добровольцев, сопоставимых с пациентами исследуемой группы по половым и возрастным характеристикам.
Для оценки степени ожирения и характера распределения жира проведены измерения антропометрических параметров: массы тела, роста, окружности талии (ОТ), окружности бедер (ОБ). Определяли индекс массы тела (ИМТ) и индекс ОТ/БО. В стандартных условиях измеряли АД.
На автоматическом биохимическом анализаторе в сыворотке крови, взятой утром натощак, определяли концентрацию глюкозы, общего холестерина (ОХС), триглицеридов (ТГ), холестерина (ХС) липопротеидов низкой и высокой...












