Акушерство и Гинекология №8 / 2022
Влияние менопаузальной гормональной терапии на развитие и прогрессирование рака шейки матки и эндометрия
ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Минздрава России, Москва, Россия
Противоопухолевая терапия злокачественных заболеваний органов репродуктивной системы часто сопровождается развитием индуцированной менопаузы. Изучение возможности безопасного назначения менопаузальной гормональной терапии (МГТ) в этой группе пациенток является актуальной задачей, поскольку большинству пациенток приходится бороться с последствиями эстрогендефицитных состояний после противоопухолевой терапии в течение многих лет. В обзоре проведен анализ имеющейся информации о частоте прогрессирования/рецидива неопластического процесса у выживших после рака шейки матки/эндометрия (РШМ/РЭ) на фоне использования МГТ. Поиск статей выполнен в соответствии с рекомендациями анализа систематических обзоров и мета-анализов (Preferred Reporting Items for Systematic Reviews and Meta-Analyses, PRISMA), представленных в PubMed и SCOPUS. Использование МГТ оценивалось в двух направлениях: как фактор риска РШМ/РЭ у женщин, не имеющих данную патологию в анамнезе; и как фактор риска рецидива/прогрессирования РШМ/РЭ. При анализе доступных публикаций не было выявлено достоверного подтверждения негативного влияния МГТ на исходы РШМ/РЭ. Назначение МГТ после благоприятного завершения противоопухолевой терапии у пациенток с плоскоклеточным РШМ в анамнезе давно является рутинной практикой. При гормонзависимых вариантах РШМ/РЭ у молодых женщин с индуцированной менопаузой вопрос о возможности использования МГТ должен быть решен в пользу имеющихся преимуществ (снижение риска возраст-ассоциированной патологии и повышение качества жизни) и оценки соответствующих рисков.
Заключение: Возможность назначения МГТ пациенткам с отягощенным онкологическим анамнезом должна обсуждаться в рамках врачебного консилиума в составе онкогинеколога, химиотерапевта и акушера-гинеколога. Необходимы дальнейшие проспективные и рандомизированные исследования для полноценной оценки влияния МГТ на онкологические исходы у выживших после РШМ/РЭ.
Рак шейки матки (РШМ) является четвертым по частоте онкологическим заболеванием, диагностируемым во всем мире, и четвертой по значимости причиной смертности от рака у женщин [1]. Благодаря программам скрининга и доступной вакцинации против вируса папилломы человека (ВПЧ) за последние несколько десятилетий заметно снизилась частота заболеваемости и смертности от РШМ [2]. Пятилетняя выживаемость в основном зависит от стадии заболевания и достигает 92% при локализованном варианте. РШМ чаще всего диагностируют у женщин репродуктивного возраста (35–44 года) [3]. Противоопухолевая терапия часто приводит к развитию индуцированной менопаузы. Сохранение фертильности (конизация, трахелэктомия) возможно при ранних стадиях плоскоклеточного РШМ (ПРШМ): при IA1 стадии без инвазии в лимфоваскулярное пространство и стадии IA1 с инвазией в лимфоваскулярное пространство или стадиях от IA2 до IB1) с низким риском рецидива рака (размер поражения <2 см и отсутствуют метастазы в лимфатические узлы). Лечение на поздних стадиях заболевания представлено лучевой терапией (40–50 Гр), платиносодержащей химиотерапией и брахитерапией (30–40 Гр) [4]. Облучение чрезвычайно токсично для яичников и характеризуется дозозависимым эффектом. Доза облучения 2 Гр сопровождается гибелью половины популяции ооцитов, тогда как доза 6 Гр может вызывать необратимый гипогонадизм. Преждевременная менопауза у женщин, перенесших противоопухолевое лечение, сопровождается внезапным началом климактерических расстройств и увеличением риска метаболических нарушений, сердечно-сосудистых заболеваний и остеопороза. Пациентки с отягощенным онкологическим анамнезом находятся в состоянии психологического стресса, который утяжеляет симптомы менопаузы и ухудшает качество жизни. МГТ остается наиболее эффективным методом коррекции климактерических расстройств [5, 6].
Плоскоклеточный рак шейки матки
В клинических исследованиях были получены противоречивые результаты в отношении взаимосвязи экспрессии эстрогеновых рецепторов (ER)α и РШМ. В работе Zhai Y. отмечалась потеря экспрессии ERα в период прогрессирования РШМ (с CIN I и CIN II/III до инвазивной плоскоклеточной карциномы) – с 50, 15 и 3,7% положительных результатов ERα, соответственно. Потеря экспрессии ERα при прогрессировании заболевания указывает на туморсупрессирующую роль эпителиального ERα в канцерогенезе шейки матки [7]. Необходимы дополнительные исследования для формирования более глубокого представления о функциональных молекулярных путях, вовлеченных во взаимосвязи между эстрогенами, ERα и онкогенами ВПЧ.
ПРШМ обычно относят к гормононезависимой опухоли. Литературные данные показывают, что лишь очень ограниченная часть женщин получает МГТ в связи с индуцированной менопаузой [8, 9].
Целью этого систематического обзора является предоставление современной информации о рисках и преимуществах МГТ после перенесенного РШМ/рака эндометрия (РЭ).
В многочисленных работах, выполненных с целью оценки риска РШМ и смертности от него при использовании МГТ, были продемонстрированы обнадеживающие результаты (см. таблицу). В наблюдательном когортном исследовании Persson I. после 13 лет наблюдения пациенток не было обнаружено доказательств неблагоприятного влияния МГТ ни на один из гистологических вариантов РШМ. Широкое проведение биопсии шейки матки у пациенток, получавших МГТ, не отличалось более высоким уровнем выявления РШМ [11].
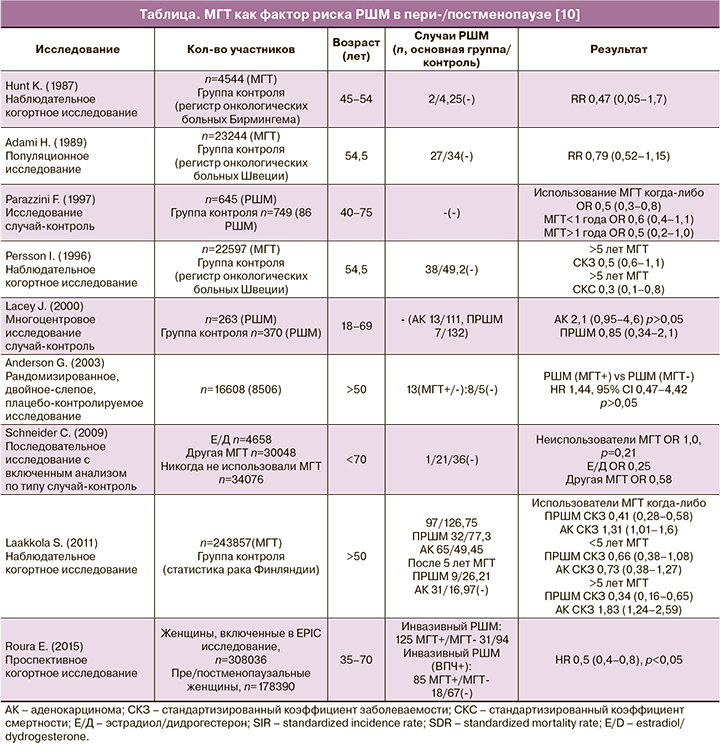
В последующем исследовании риск развития РШМ оценивали у пользователей различной по составу МГТ и сравнивали с группой контроля. Общая популяция исследования состояла из 69 412 женщин в пре- и постменопаузе: 4658 женщин, принимали эстрадиол/дидрогестерон (Э/Д), 30 048 женщин – другие виды МГТ, и 34 706 женщин составили группу контроля. Среднее время наблюдения составило 6,0 лет в основных группах и 5,7 лет для группы контроля. Анализ риска заболеваемости РШМ в зависимости от типа МГТ не выявил статистически значимой разницы между пользователями Э/Д и другими типами МГТ (Э/Д: OR 0,25, 95% ДИ 0,03–2,17; другая МГТ OR: 0,58, 95% ДИ 0,31–1,08) по сравнению с группой контроля [12].
В проспективном исследовании было показано, что у 308 036 женщин МГТ снижает риск инвазивного РШМ (OR 0,5, 05% ДИ 0,4–0,8), особенно в подгруппе плоскоклеточного подтипа вне зависимости от ВПЧ статуса. В работе была установлена слабая обратная взаимосвязь между приемом МГТ и аденокарциномой [13].
За последние 2 десятилетия резко увеличилась частота выявления плоскоклеточных карцином (ПК), связанных с ВПЧ. ПК (ВПЧ+) и ПК (ВПЧ-) отличаются друг от друга гено- и фенотипически с точки зрения их патологических/молекулярных механизмов канцерогенеза и их реакции на терапию. На культуре клеток ПК при ВПЧ положительном статусе пациенток было выявлено, что высокая экспрессия ER ассоциирована с лучшими показателями выживаемости. При обработке культуры клеток (ВПЧ+) эстрогенами отмечалось подавление экспрессии вирусной РНК, транскрипции вирусных генов, а также зафиксирована реактивация опухолевых супрессоров pRb и р53 [14].
Исследование Ploch E. – единственное исследование с анализом влияния МГТ на частоту рецидивов РШМ и общую выживаемость в ка...
2 см>











