Фарматека №1 (254) / 2013
Влияние микрофлоры на функции желудочно-кишечного тракта
В статье изложены современные представления о механизмах влияния микрофлоры на местную иммунную систему кишечника и воздействия микрофлоры на эту полифункциональную жизненно важную систему организма. На основании серьезных научных исследований, доказывающих многогранный положительный эффект пробиотических штаммов на организм, использование их в современных условиях показано в педиатрической практике. Применение препарата Нарине, содержащего Lactobacillus acidophilus, вполне обоснованно, т. к. он является эффективным методом восстановления как состава нормальной микрофлоры, так и функций желудочно-кишечного тракта.
Желудочно-кишечный тракт (ЖКТ) человека представляет собой открытую биологическую систему, которая находится в постоянном контакте с внешней средой, в т. ч. с различными микроорганизмами. На слизистой оболочке кишечника концентрация микроорганизмов составляет более 1010-12 колониеобразующих единиц (КОЕ)/г, в то время как на коже она достигает 105-6 КОЕ/г. Видовой состав микробиологического пейзажа в кишечнике представлен более 450–500 видами бактерий, не считая персистирующих вирусов, простейших, а также грибов. Соотношение строго анаэробных бактерий (Lactobacillus, Вifidobacterium, Clostridium, Bacteroides, Prevotella, Actinimyces, Fusobacteriaи др.) к аэробным (Enterococcus, Staphylococcus, Escherichiaи др.) в толстой кишке составляет 1000/1 [1, 2]. Количественные соотношения между различными микробными популяциями характеризуются определенной стабильностью и формируются с первых дней жизни ребенка.
Первоначальная колонизация кишечника ребенка имеет большое значение для формирования биоценоза взрослого человека. Продемонстрировано, что бактерии, первыми прикрепившиеся к эпителию кишечника и ставшие резидентами, могут изменять экспрессию генов энтероцитов хозяина, создавая благоприятные условия для собственного существования и препятствуя колонизации другими микроорганизмами. Например, Bacteriodes thetaiotaomicron модифицируют степень гликозилирования слизистой оболочки за счет изменения активности гена колоноцита, кодирующего гликозилтрансферазу, и тем самым создают наиболее оптимальную для себя экологическую нишу [3, 4].
Колонизация пищеварительного тракта ребенка происходит во время родов – при прохождении через родовые пути матери, в которых у здоровой женщины колонизированы преимущественно лактобациллы и бифидобактерии. Характер родоразрешения в значительной мере влияет на видовой состав заселяющейся микрофлоры. У детей, рожденных путем кесарева сечения, нарушается процесс формирования нормального биоцноза: отмечается снижение уровня бифидобактерий, повышение клостридий и бактероидов. После рождения продолжается колонизация ЖКТ новорожденного различными микроорганизмами от матери, персонала и окружающей среды [5].
“Идеальными” условиями для правильного формирования биоценоза кишечника можно считать совместное пребывание матери и ребенка с первых часов жизни и естественное вскармливание. В этом случае ребенок контактирует с микроорганизмами, с которыми уже взаимодействовала иммунная система матери.
Основными механизмами, участвующими в контроле качественного и количественного состава микробиоцeноза в кишечнике, являются неспецифические и специфические факторы иммунологической защиты (табл. 1), созревание которых в свою очередь происходит под воздействием микрофлоры кишечника.
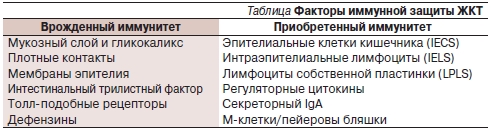
Местная иммунная система пищеварительного тракта представлена лимфоидной тканью кишечника (GALT – gut-associated lymphoid tissue), которая включает различные клетки или скопления клеток, расположенных как в эпителии собственной пластинки слизистой оболочки, так и в подслизистом слое. Эффективность работы GALT-системы зависит от заселения кишечника индигенной микрофлорой. M-клетки, расположенные в слизистой оболочке кишечника, путем эндоцитоза осуществляют доставку микробных антигенов из просвета кишечника в лимфоидную ткань с последующей презентацией этого антигена лимфоцитам [6]. После презентации антигенов Т-хелперам и макрофагам происходит трансформация Th0-клеток в Th1 или в Th2. Трансфорация в Th1 сопровождается выработкой провоспалительных цитокинов: интерлейкина-1 (ИЛ-1), фактора некроза опухоли α и интерферона γ, активацией фагоцитоза, миграцией нейтрофилов, усилением окислительных реакций и синтезом иммуноглобулина А (IgA). Все эти реакции направлены на элиминацию антигена. Дифференцировка в Th2 способствует выработке противовоспалительных цитокинов: ИЛ-4, ИЛ-5 и ИЛ-10. С одной стороны, с помощью такого механизма осуществляется контролируемое противостояние чужеродному для организма антигенному материалу, с другой – одновременное сосуществование с собственной микрофлорой [7, 8].
К компонентам иммунной системы ЖКТ также относят мукозный слой (муцин), покрывающий эпителиальные клетки (см. рисунок). Секреты бокаловидных клеток – слизистые гликопротеиды и интестинальный трилистный фактор (ITF), образуют слизистый гель, который служит серьезной преградой для микроорганизмов. Антимикробные пептиды и протеины, секретируемые клетками Панета, также представлены в муцине. Клетки Панета играют важную роль в иммунной защите слизистой оболочки кишки. Это специализированные эпителиальные клетки, расположенные в основании мелких интестинальных крипт и контролирующих просвет кишечника. Они способствуют защите организма и поддержанию гастроинтестинального барьера посредством секреции в просвет кишечника ряда антибактериальных белков (дефензинов, лизоцима и секреторной фосфолипазы А2) [9, 10], которые защищают близлежащие клетки и контролируют плотность микроорганизмов. Часть этих белков содержится в клетках Панета в виде гранул и ресин...












