Кардиология №12 / 2014
Влияние основных факторов риска у пациентов на прогноз при декомпенсации сердечной недостаточности
ГБОУ ВПО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава РФ, 117997 Москва, ул. Островитянова, 1
В мире насчитывают около 23 млн пациентов, страдающих хронической сердечной недостаточностью (ХСН), их число продолжает неуклонно расти.
В настоящее время декомпенсация ХСН является частой причиной госпитализации [1]. Известно, что ХСН сочетается со многими заболеваниями и синдромами, которые оказывают как самостоятельное, так и сочетанное в комбинации с основным заболеванием влияние на частоту повторных госпитализаций и смертность. Выявление предикторов с наиболее значимым влиянием на частоту развития летальных исходов позволило бы на ранних этапах декомпенсации кровообращения определиться с прогнозом и корригировать терапию [2].
 Целью настоящего исследования явилось изучение влияния различных сопутствующих заболеваний и симптомов, формирующих фенотип пациентов, на прогноз при декомпенсации систолической ХСН.
Целью настоящего исследования явилось изучение влияния различных сопутствующих заболеваний и симптомов, формирующих фенотип пациентов, на прогноз при декомпенсации систолической ХСН.
Материал и методы
Проанализирована база данных «Павловского регистра» [3]. Регистр сформирован в 2009 г. и включает 1001 пациента с декомпенсацией ХСН. Проанализирован период наблюдения сроком 1 год с контрольными точками на 30-й, 90, 180 и 360-й дни со дня выписки. Клиническая характеристика пациентов представлена в табл. 1.
Критерии включения в исследование: возраст >18 лет,наличие систолической ХСН, причина госпитализации — декомпенсация ХСН, скорость клубочковой фильтрации (СКФ) по формуле MDRD>15 мл/мин/1,73 м2. Критерии исключения: алкогольная кардиомиопатия, фракция выброса (ФВ) левого желудочка (ЛЖ) >40%.
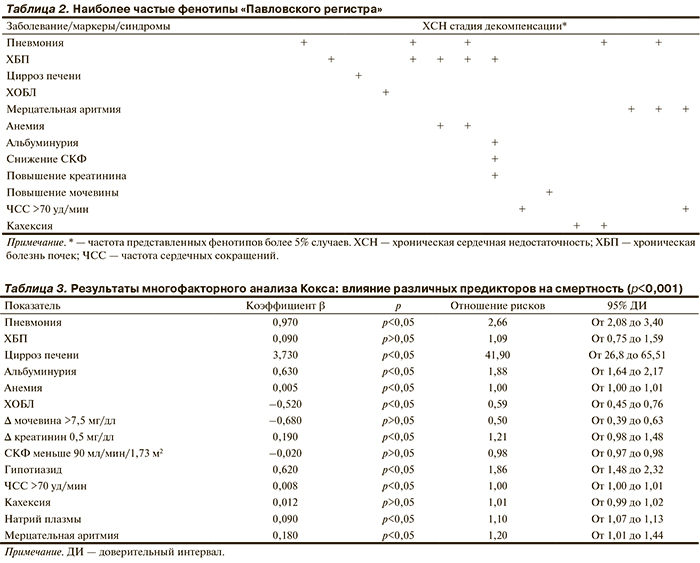
Характеристика групп больных. Анализ «Павловского регистра» показал, что наиболее частые сочетания декомпенсации кровообращения и какого-либо заболевания или синдрома, или лабораторного показателя являются параметры, приведенные в табл. 2. Таким образом, самыми частыми фенотипами являются сочетания ХСН+пневмония+хроническая болезнь почек (ХБП).
С целью выделения наиболее значимых предикторов смертности у больных ХСН построена модель пропорциональных рисков Кокса с зависящими от времени ковариатами (табл. 3). Согласно представленным данным, модель является достоверной (p<0,001), наиболее значимыми оказались следующие предикторы (значимость указана в порядке убывания): цирроз печени, пневмония, альбуминурия, прием тиазидного диуретика на догоспитальном этапе, мерцательная аритмия постоянной формы, повышение уровня креатинина и натрия в плазме крови на этапе госпитализация-выписка, наличие ХБП, дефицит тощей массы тела (кахексия), исходный уровень гемоглобина <110 г/л, частота сердечных сокращений (ЧСС) >70 уд/мин на момент выписки.
Проанализировано влияние комбинации предикторов на смертность в течение года. Анализ позволил выявить комбинации предикторов, оказывающих преимущественное влияние на ранний прогноз (в течение первых 6 мес), поздний прогноз (после 6 мес) и оказывающие одинаковое влияние на всем этапе наблюдения.
Статистическую обработку полученных данных проводили с помощью программного обеспечения Statistica 10.0. Нормальность распределения определялась с помощью критерия Шапиро—Уилка. Использовали методы непараметрической и параметрической статистики. Количественные показатели представлены в виде среднего значения (M)±стандартное отклонение (S). Проводили многофакторный анализ с помощью модели пропорциональных рисков Кокса. Анализ выживаемости выполняли с помощью метода Каплана—Мейера. Статистически значимыми признавали различия при р<0,05.
Результаты
Ранние предикторы смертности. Анализ влияния прироста концентрации мочевины на этапе госпитализация-выписка на смертность пациентов с декомпенсацией ХСН (рис. 1) показал, что смертность начинает повышаться с 30-го дня после выписки из стационара, значимость влияния сохраняется до 150-го дня наблюдения. Бόльшая часть летальных исходов (48%) приходилась на период от 3 до 6 мес; 24% смертей приходилось на период до 60-го дня наблюдения. Менее значимым оказался период после 6 мес наблюдения, так как смертность в этот период составила 28%.
При изучении влияния анемии (исходный уровень гемоглобина <110 г/л) на смертность пациентов с декомпенсацией ХСН (рис. 2) показано, что снижение уровня гемоглобина также является ранним предиктором смерти таких пациентов. Как можно видеть из рисунка, расхождение кривых смертности начинается с первых дней от момента выписки и продолжается вплоть до 150-го дня наблюдения. Наиболее значительным уровень смертности оказался в первые 30 дней после выписки, составив 20%. Примерно тот же уровень смертности (25%) сохранялся в период с 60-го по 90-й день наблюдения. На последующих этапах наблюдения число летальных исходов было существенно меньше. С 200-го дня наблюдения отмечался рост смертности у пациентов без исходной анемии.
Анализ ЧСС показал, что у пациентов с ЧСС>70 уд/мин на момент выписки смертность существенно выше, чем у пациентов, им...
0,001),>











