Урология №3 / 2018
Влияние пероральных сахароснижающих препаратов на литогенные свойства мочи больных нефролитиазом на фоне сахарного диабета 2 типа
НИИ урологии и интервенционной радиологии им. Н. А. Лопаткина – филиал ФГБУ НМИЦ радиологии Минздрава России, Москва, Россия; ФГБОУ ВО РНИМУ им. Н. И. Пирогова, Москва, Россия; ГБУЗ ГКБ им. Д. Д. Плетнева Департамента здравоохранения Москвы, Москва, Россия; ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет), Москва, Россия
Цель исследования: изучить влияние пероральных сахароснижающих препаратов на литогенные свойства мочи больных нефролитиазом на фоне сахарного диабета 2 типа.
Материалы и методы. Статья основана на результатах обследования и лечения 376 пациентов, страдавших рецидивирующим нефролитиазом и медикаментозно компенсированным сахарным диабетом 2 типа, проходивших лечение в НИИ урологии и интервенционной радиологии им. Н. А. Ло-
паткина – филиал ФГБУ НМИЦ радиологии Минздрава России и отделение эндокринологии ГБУЗ ГКБ им. Д. Д. Плетнева Департамента здравоохранения г. Москвы в 2012–2017 гг.
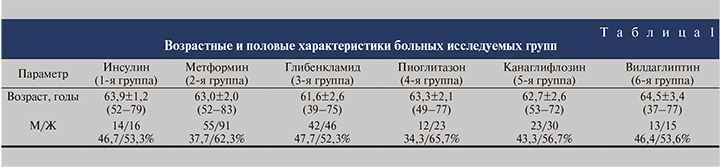
Пациенты были разделены на пять групп, согласно примененному пероральному сахароснижающему средству: метформин, глибенкламид, пиоглитазон, канаглифлозин, вилдаглиптин. Контрольную группу составили пациенты, получавшие терапию инсулином.
Результаты. Продемонстрирована склонность метформина закислять мочу, что имеет негативное влияние в условиях уратного нефролитиаза, занимающего доминирующее положение по частоте распространенности в популяции пациентов, страдающих сахарным диабетом 2 типа.
Глибенкламид, наоборот, несколько защелачивает мочу, однако изменения рН мочи под влиянием препарата не выходят за пределы нормальных значений.
Пиоглитазон увеличивает плотность мочи с одновременной тенденцией к снижению диуреза, что негативно влияет при любой форме нефролитиаза.
Эмпаглифлозин увеличивает диурез за счет медикаментозно индуцированной глюкозурии, также увеличивает почечную экскрецию солей мочевой кислоты. Однако при нормальных значениях рН мочи урикозурический эффект препарата не сопровождается существенным повышением риска уратного камнеобразования.
Вилдаглиптин не оказывает существенного влияния на диурез, реакцию мочи и почечную экскрецию солей.
Заключение: лекарственная терапия сахарного диабета 2 типа существенно влияет на свойства мочи больных нефролитиазом и должна учитываться при метафилактике нефролитиаза.
Введение. Проблема патогенеза нефролитиаза – одна из ключевых в современной урологии. Этиология мочекаменной болезни все еще остается до конца не ясной. Однако многие аспекты сложного процесса камнеобразования разработаны достаточно подробно. Например, сравнительно хорошо изучены многочисленные факторы риска формирования почечных конкрементов. Значительную роль играют так называемые немодифицируемые факторы, в частности пол, возраст пациента, принадлежность к тому или иному этносу, географическое расположение местности, где проживает больной, генетические особенности. Между тем все больший интерес современных исследователей привлекают «модифицируемые» факторы риска мочекаменной болезни, такие как ожирение, сахарный диабет (СД) и метаболический синдром.
Сахарный диабет 2 типа (СД2) – ведущий компонент метаболического синдрома, а происходящие при этом нарушения метаболизма могут негативно влиять на функцию почек и состав мочи, повышая ее литогенную активность [1, 2]. Показано, что абдоминальное ожирение, гипергликемия и СД2 независимо коррелируют с повышенным риском нефролитиаза [3–5]. Это связано с одновременным действием двух групп факторов – метаболическими нарушениями, ведущими к развитию инсулинорезистентности и гипергликемии, а также изменениями в составе мочи, способствующими камнеобразованию вследствие действия тканевого воспаления, и молекулярными нарушениями, влияющими на транспорт метаболитов в почке [6].
Эти пациенты в большинстве своем получают лекарственную терапию, направленную на коррекцию нарушений углеводного обмена, которая потенциально может влиять на риск камнеобразования как в положительную, так и в отрицательную сторону.
Современная фармакология для лечения СД2 предлагает достаточно обширный выбор препаратов для перорального приема с различным механизмом действия:
- производные сульфонилмочевины – стимулируют секрецию инсулина островковыми клетками;
- бигуаниды – повышают чувствительность тканей организма к инсулину, на фоне чего снижается масса тела больного, улучшается липидный состав крови;
- производные тиазолидинона (глитазоны) – снижают инсулинорезистентность главным образом жировой и мышечной ткани, нормализуют соотношение липидов в крови;
- ингибиторы α-глюкозидазы – блокируют усвоение углеводов на уровне желудочно-кишечного тракта;
- ингибиторы дипептидилпептидазы-4 (глиптины) и инкретины – опосредованно (через гастроинтестинальные гормоны) стимулируют секрецию инсулина;
- ингибиторы натрий-глюкозного котранспортера II типа (глифлозины) – угнетают реабсобцию глюкозы в проксимальном канальце, вызывая почечную глюкозурию.
В литературе имеются указания, будто пероральные противодиабетические препараты могут влиять на литогенные факторы мочи и в зависимости от фармакологической группы уменьшать или увеличивать кристаллообразование, вероятность камнеобразования.
Широко используемый в современной эндокринологической практике метформин в опытах на клеточных культурах и на крысах с индуцированной гипероксалурией уменьшал повреждение клеток, индуцированное добавлением к культуре клеток оксалатов, предотвращал рост концентрации маркера перекисного окисления липидов (малонового диальдегида) и снижение активности антиоксидантного фермента супероксидоксидазы, а в опытах in vivo снижал кристаллообразование оксалатов [7]. Канаглифлозин, относящийся к группе ингибиторов натрий-глюкозного котранспортера II типа, снижает концентрацию мочевой кислоты в крови больных СД2 с гиперурикемией на 23–32% [8]. Пиоглитазон у крыс с моделированной гипероксалурией уменьшал кристаллообразование, что сопровождалось снижением маркеров оксидантного повреждения клеток и их апоптоза [9]. Представленные данные свидетельствуют о потенциальной значимости почечных эффектов сахароснижающих средств в условиях нефролитиаза. Однако вышеупомянутые исследования были проведены без комплексной оценки влияния этих препаратов на биохимические параметры крови и мочи, от которых зависит вероятность рецидива камнеобразования.
Цель исследования: изучить влияние пероральных сахароснижающих препаратов на литогенные свойства мочи больных нефролитиазом на фоне СД2.
Материалы и методы. Для оценки влияния лекарственной терапии СД2 на процесс камнеобразования обследованы 376 пациентов, страдавших рецидивирующим нефроли...












