Фарматека №15 (308) / 2015
Влияние пробиотиков на состав микрофлоры толстой кишки и уровень сывороточных цитокинов у пациентов с синдромом раздраженного кишечника
ФГБУ Государственныйнаучныйцентрколопроктологии им. А.Н.Рыжих Минздрава России, Москва
Представлены результаты исследования, целью которого являлось определение особенностей состава кишечной микрофлоры и иммунного статуса у пациентов с различными формами синдрома раздраженного кишечника (СРК) на фоне терапии мультиштаммовымипробиотическими комплексами. После лечения отмечался рост уровня как про-, так и противовоспалительных цитокинов. Данные изменения могут свидетельствовать о том, что при появлении в просвете кишечника большого количества микроорганизмов активизируется местная иммунная система. При оценке клинической картины обращало на себя внимание уменьшение длительности и интенсивности таких симптомов, как боль в животе и вздутие. В связи с этим представляется целесообразным рекомендовать многоштаммовыепробиотики в сочетанной терапии с препаратами, нормализующими перистальтическую активность кишечник.
Синдром раздраженного кишечника (СРК) – функциональное расстройство, при котором боль или дискомфорт в животе уменьшаются после дефекации, связаны с изменением частоты и консистенции стула, возникают не менее 3 дней в месяц на протяжении последних 3 месяцев при общей продолжительности жалоб не менее 6 месяцев [1, 3]. На сегодняшний день СРК страдают около 15–20 % населения земного шара [2, 4–6].
Наиболее часто СРК диагностируют у лиц молодого трудоспособного возраста. Поэтому заболевание наносит большой экономический ущерб обществу как в плане прямых затрат на медицинское обслуживание и лечение, так и по непрямым показателям, включающим компенсацию временной нетрудоспособности [7].
В течение длительного времени диагноз СРК расценивался как сугубо функциональное заболевание, устанавливался на основании Римских критериев-III. Однако многие исследователи не теряют надежды выявить какое-либо органическое изменение или патофизиологический механизм, способный выявить субстрат заболевания [8, 9] и объяснить причину возникновение симптомов СРК.
Многие исследования патогенеза СРК в последние десятилетия были сосредоточены на моторике толстой кишки, висцеральной гиперчувствительности и взаимодействии мозга и кишки («brain-gut axis»). На сегодняшний день особое внимание уделяется таким процессам, как воспаление, в особенности постинфекционное [10], иммунологические факторы [11] и изменения кишечной микрофлоры [12]. Доказательства их роли в развитии СРК в настоящее время изучаются.
Одной из возможных причин развития СРК может быть измененная кишечная микрофлора [12]. Важная функция микрофлоры – защитная, т.к. бактерии – симбионты человека, обладают выраженной антагонистической активностью по отношению к патогенным и условно-патогенным микроорганизмам. Любое количественное или качественное изменение в толстокишечной микрофлоре может приводить к нарушению просветной экосистемы. Это облегчает патогенным микроорганизмам возможность подойти вплотную к эпителиальным клеткам выстилки. При дегрануляции тучных клеток выделяются вещества, которые увеличивают проницаемость слизистой оболочки, что приводит к нарушению целостности белковых контактов. Просветные микроорганизмы или продукты их жизнедеятельности, такие как пептидогликаны или липополисахариды, взаимодействуют с Toll-подобными рецепторами (TLR – Toll-like receptor) на дендритных клетках и макрофагах. Антигены, представленные на этих клетках, взаимодействуют с Т-клетками, что приводит к образованию цитокинов и хемокинов, провоцирующих развитие воспаления в желудочно-кишечном тракте. Таким образом, изменение состава кишечной микрофлоры может приводить к изменениям иммунного статуса пациентов с СРК.
Существует не так много работ, оценивавших состояние цитокинового профиля при СРК. T.G. Dinan, G. Clarke и соавт. исследовали 88 пациентов, из них 37 – с СРК: 18 – с СРК-Д (СРК с преобладанием диареи), 14 – смешанная форма, 5 – с СРК-З (СРК с пребладанием запоров), 14 – с выявленной депрессией и 37 – группа здоровых пациентов. В данных группах исследовался уровень интерлейкина-6 (ИЛ-6), -8 и -10. Выявлено, что уровень ИЛ-6 (р=0,003) и -8 (р=0,001) значительно выше у пациентов с СРК, чем в контрольной группе [13].
Дополнительным свидетельством измененной кишечной иммунной активации является повышение экспрессии TLR при СРК [14], причем степень экспрессии TLR2 и TLR4 значительно отличается среди подтипов СРК. Повышенная экспрессия TLR при смешанном типе СРК спровоцировала усиление внутриклеточной передачи сигнала, что привело к повышенной экспрессии в слизистой оболочке провоспалительных цитокинов ИЛ-1 и -8 [15]. A.C. Villani и соавт. [16] предположили наличие генетических факторов риска развития постинфекционного СРК на основе исследования когорты из 2300 пациентов. Они обнаружили, что TLR9 и ИЛ-6 сохранялись в качестве независимых факторов риска при постинфекционном СРК. В нескольких исследованиях были определены конкретные генетические полиморфизмы провоспалительных цитокинов, которые оказывают влияние на моторику, эпителиальную проницаемость и висцеральную чувствительность [17–19]. Фактор некрза опухоли α (ФНО-α) производится моноцитарными активированными макрофагами, и этот цитокин играет важную роль в поддержании хронического воспаления, например при воспалительных заболеваниях кишечника [20]. По данным исследования, в Нидерландах увеличение ФНО-α было достоверно выявлено у пациентов с СРК по сравнению с контрольной группой, в то же время не было найдено связи с полиморфизмом в гене, контролирующем выработку ИЛ-10 [11], противовоспалительного цитокина, участвующего в регуляции иммунного и воспалительного ответов.
Таким образом, клиническая картина пациентов с СРК может быть обусловлена нарушением состава микрофлоры и как следствие – изменением количественного и качественного состава цитокинов.
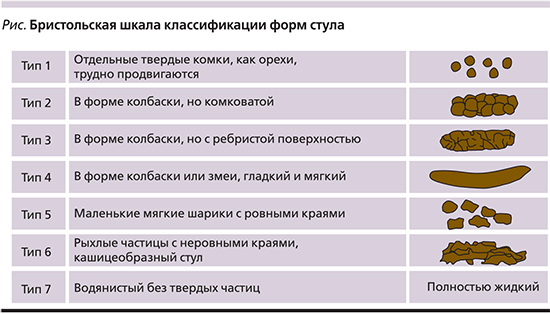
Существуют различные методы ко...












