Урология №6 / 2015
Восстановление сперматогенеза путем аллогенной трансплантации недифференцированных клеток Сертоли в экспериментальной модели двустороннего абдоминального крипторхизма
ФГБУН «Институт биологии развития им. Н. К. Кольцова» РАН; ФГБУ «ФНИЦЭМ им. Н. Ф. Гамалеи» Минздрава России; отделение репродуктивного здоровья «Научный центр здоровья детей»; медицинский факультет Российского университета дружбы народов
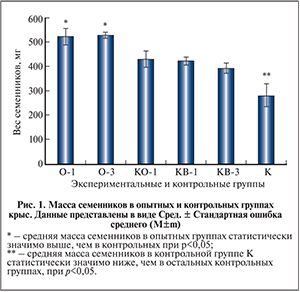
Изучено влияние аллогенной трансплантации недифференцированных клеток Сертоли на тестикулярную ткань экспериментальных животных на модели двустороннего абдоминального крипторхизма. Эффективность трансплантации недифференцированных клеток Сертоли оценивали через 1 и 3 мес. после инъекции. Установлено, что после трансплантации происходит частичное восстановление семенных канальцев, в трети из них встречаются половые клетки на всех стадиях дифференциации, что не определялось в группах контроля.
Введение. За последнее время, по данным ВОЗ, частота бесплодия в браке не только не уменьшается, но продолжает расти. Установлено, что доля мужской инфертильности за последние 20 лет увеличилась с 8–10 до 30–40% всех случаев бесплодия [1]. Одна из причин мужского бесплодия – крипторхизм – аномалия, связанная с неопущением одного или двух яичек в мошонку. Дислокация яичка – распространенное нарушение развития репродуктивной системы, встречающееся у 30% недоношенных и 4% доношенных новорожденных [2]. В связи с этим в течение многих лет крипторхизм и его осложнения находятся в центре внимания исследователей и врачей [3].
Традиционные методы лечения крипторхизма недостаточно эффективны. Так, гормональная терапия (с использованием хорионического гонадотропина) – метод лечения, который широко применяется уже более 30 лет, но эффективность его оценивается неоднозначно [4] и по сравнению с группой плацебо не превышает 10% [5]. Другой метод – операция орхипексии (опущение яичка в мошонку) – часто не обеспечивает ожидаемого восстановления сперматогенеза, особенно при двусторонних формах крипторхизма, и проводится больше в профилактических целях.
В настоящее время появляются новые подходы к восстановлению сперматогенеза, пока находящиеся на стадии разработки на лабораторных животных. Один из таких подходов – искусственный гаметогенез – дифференцировка мужских половых клеток из эмбриональных стволовых клеток (ЭСК) или индуцированных плюрипотентных стволовых клеток in vitro. В ряде работ ЭСК в культуре под действием специфических индукторов удавалось дифференцировать в гаплоидные мужские половые клетки, которые затем использовали для искусственного оплодотворения [6, 7]. Однако существующие методы искусственного гаметогенеза характеризуются низкой эффективностью: только 0,01% всех клеток достигает гаплоидного состояния. К существенным недостаткам описанного подхода относятся нарушения дифференцировки половых клеток [8, 9], которые происходят из-за отсутствия in vitro естественного микроокружения.
Другой подход к восстановлению мужской фертильности предполагает использование сперматогониальных стволовых клеток (ССК). Разработаны методики выделения, культивирования ССК [10–12] и их трансплантации в семенники животных с нарушенным сперматогенезом [13, 14]. В случае повреждения только половых клеток трансплантации ССК способны восстановить сперматогенез [15]. Однако в случае с крипторхизмом нарушение в значительной степени затрагивает не ССК, а их микроокружение – клетки Сертоли (КС) [16–18]. Клетки Сертоли – соматические клетки семенника, поддерживающие развитие половых клеток; являются основой структуры семенных канальцев, источником многих факторов роста и дифференцировки для половых клеток, выполняют трофическую функцию и многие другие. Без этих клеток развитие половых клеток невозможно.
 В литературе отсутствуют данные о восстановлении сперматогенеза после крипторхизма у животных путем аллогенной клеточной трансплантации. Тем не менее на другой модели – локального облучения семенников крыс (так же как и крипторхизм, необратимо нарушающий функцию КС [19]) путем аллогенной трансплантации в интерстициальную ткань семенника недифференцированных КС [НКС]) 12–13-суточных крысятам удалось достичь частичного восстановления сперматогенеза в семенных канальцах реципиента [20].
В литературе отсутствуют данные о восстановлении сперматогенеза после крипторхизма у животных путем аллогенной клеточной трансплантации. Тем не менее на другой модели – локального облучения семенников крыс (так же как и крипторхизм, необратимо нарушающий функцию КС [19]) путем аллогенной трансплантации в интерстициальную ткань семенника недифференцированных КС [НКС]) 12–13-суточных крысятам удалось достичь частичного восстановления сперматогенеза в семенных канальцах реципиента [20].
Цель настоящей работы: исследовать влияние аллогенной трансплантации НКС на восстановление сперматогенеза после моделирования двустороннего абдоминального крипторхизма.
Материалы и методы. В работе были использованы 50 крысят линии Вистар: 30 животным в возрасте 15 дней (возраст выбирали, основываясь на результатах наших предыдущих исследований [3]) проводили операцию по фиксации семенников в брюшной полости (реципиенты), 20 крысят в возрасте 10 дней использовали как доноров НКС для трансплантации. Крыс содержали в стандартных условиях вивария с режимом день/ночь 12 ч/12 ч, воду и корм животные получали ad libitum.
Животные были разделены на 6 групп по 4–5 крыс в каждой.
Контрольная группа (К) – контроль состояния сперматогенной ткани после крипторхизма, крыс выводили из эксперимента на момент низведения семенников из брюшной полости в мошонку через 90 сут. после моделирования крипторхизма.
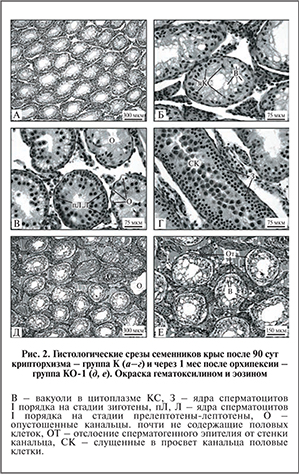 Контрольная группа (КО-1) – животным после смоделированного 90-суточного двустороннего абдоминального крипторхизма проводили орхипексию и выводили из эксперимента через 1 мес. после операции.
Контрольная группа (КО-1) – животным после смоделированного 90-суточного двустороннего абдоминального крипторхизма проводили орхипексию и выводили из эксперимента через 1 мес. после операции.
Контрольные группы (КВ-1 и КВ-3) – животным после смоделированного 90-суточного двустороннего абдоминального крипторхизма проводили орхипексию и вводили в интерстициальную ткань семенника среду без клеток, крыс выводили из эксперимента через 1 и 3 мес. после операции соответственно.
...











