Кардиология №5 / 2015
Возрастные изменения диастолической функции миокарда левого желудочка, уровня NT-proBNP и изучение их связи с длиной теломер лейкоцитов
1ФГБУ Государственный научно-исследовательский центр профилактической медицины Минздрава РФ, Москва; 2ФГБОУ ВО Московский государственный университет им. М.В. Ломоносова
Сердечно-сосудистые заболевания (ССЗ), как правило, считаются зависящими от возраста. С течением времени происходит старение сердечно-сосудистой системы, что приводит к изменению структуры и функции сердца, сосудов, создавая тем самым субстрат для развития болезней.
Однако хронологический возраст не всегда отражает истинное биологическое старение и связанный с ним риск. В связи с этим в настоящее время ведутся изучение физиологических возрастных изменений сердечно-сосудистой системы у практически здоровых людей и разработка количественных показателей, позволяющих оценивать степень таких изменений и проводить стратификацию риска развития ССЗ [1].
С увеличением возраста даже в отсутствие ССЗ миокард левого желудочка (ЛЖ) подвергается ремоделированию, изменяется его сократительная деятельность. При этом систолическая функция ЛЖ в покое не нарушается, а изменения возникают в основном в диастолическую фазу сердечного цикла [2]. Исследования показали, что чувствительным маркером изолированной диастолической дисфункции (ДД) является повышение уровня N-концевого фрагмента предшественника мозгового натрийуретического пептида (NT-proBNP) [3]. Кроме того, отмечено его повышение с увеличением возраста у лиц без ССЗ независимо от нарушений диастолической функции ЛЖ [4]. Это стало предпосылкой к изучению уровня NT-proBNP для уточнения его роли в возрастных изменениях сердца.
Типичное возрастное ремоделирование миокарда ЛЖ зависит от воздействия различных факторов риска развития ССЗ. Оценка лишь структуры и функции сердца не позволяет судить о независимом влиянии возраста на миокард. Это создает предпосылки для поиска маркеров, которые отражали бы истинное старение миокарда ЛЖ в условиях совокупного воздействия различных факторов.
Мы предположили, что возможным механизмом развития ДД миокарда ЛЖ с увеличением возраста является старение кардиомиоцитов. Старение клетки сопровождается снижением ее функционального потенциала, а также ведет к ее гибели, замещению соединительной тканью и компенсаторной гипертрофии других кардиомиоцитов [5]. Одним из маркеров старения клетки служит длина теломер лейкоцитов периферической крови. Теломеры — повторяющиеся нуклеотидные последовательности ДНК (TTAGGG), расположенные на концах каждой хромосомы. Теломерная ДНК способна поддерживаться ферментом теломеразой. Так как активность теломеразы в соматических клетках низкая, длина теломер прогрессивно сокращается при каждом делении клетки, и, достигнув критически короткой длины, ведет к остановке клеточного цикла, старению и гибели клетки [6].
Длина теломер как маркер репликативного старения должна быть связана, как минимум, со старением пролиферирующих тканей. До недавнего времени считалось, что кардиомиоциты являются репликативно неактивными клетками во взрослом периоде. Однако установлено, что наряду с неделящимися клетками есть популяция репликативно активных кардиомиоцитов. Так, в миокарде отмечено уменьшение длины теломер с увеличением возраста [7].
В данной работе оценивалась длина теломер в клетках периферической крови. Известно, что ткани с разной пролиферативной активностью имеют сходную скорость укорочения теломер, несмотря на отличие по их длине. Одним из объяснений такой эквивалентности является связь длины теломер в соматических тканях с репликацией стволовых клеток, скорость деления которых одинакова для всех тканей независимо от их пролиферативного статуса. Поэтому измерение длины теломер в легкодоступных тканях, таких как кровь, может служить в качестве суррогатного параметра для определения относительной длины теломер в других тканях [8].
Цель исследования: оценить диастолическую функцию ЛЖ и уровень NT-proBNP у лиц разного возраста без клинических проявлений ССЗ и их связь с длиной теломер.
Материал и методы
Отбор участников. На этапе скрининга были обследованы 188 человек разного возраста. Предварительный скрининг включал сбор анамнеза, оценку артериального давления (АД), частоты сердечных сокращений (ЧСС), индекса массы тела (ИМТ, кг/м2). Лица, имеющие симптомы или анамнез ССЗ (в том числе артериальную гипертонию, инсульт, ишемическую болезнь сердца, заболевания периферических артерий, сердечную недостаточность (СН), пороки сердца) и тяжелых соматических заболеваний, а также с ИМТ ≥30 кг/м2, были исключены из исследования. У включенных в исследование участников брали образцы крови для лабораторных анализов (клинический и биохимический), регистрировали электрокардиограмму (ЭКГ) и выполняли пробу с физической нагрузкой (тредмил-тест по протоколу BRUCE, Intertrack, SCHILLER). Лица с отклонениями в анализах крови, нарушениями ритма и проводимости сердца по данным ЭКГ и положительной пробой с физической нагрузкой были также исключены из исследования.
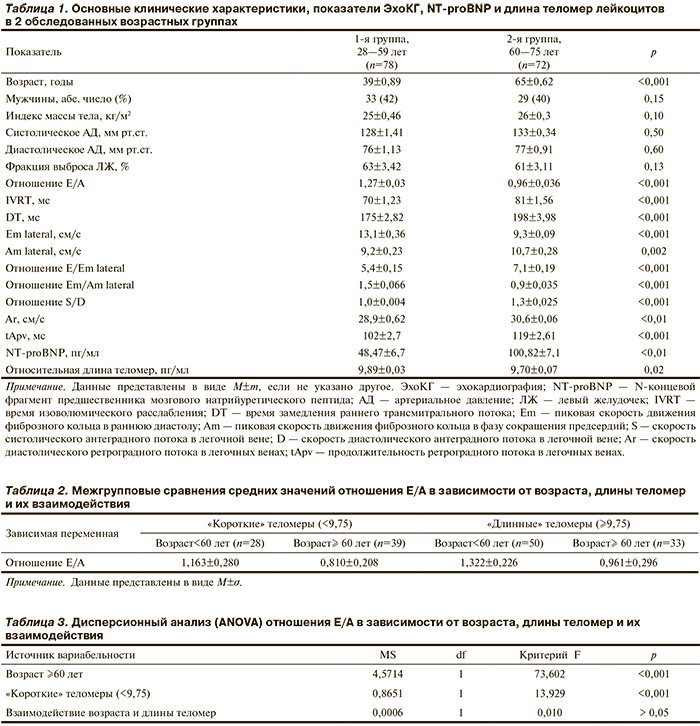
В исследование были включены 150 человек в возрасте 28—75 лет. Всем выполнены эхокардиография (ЭхоКГ), определени...












