Акушерство и Гинекология №8 / 2017
Вспомогательные репродуктивные технологии у супружеских пар с высоким риском генетических нарушений. Преимплантационный генетический скрининг
ФГБУ Научный центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова
Минздрава России, Москва
Цель исследования. Провести системный анализ данных, имеющихся в современной литературе, о роли преимплантационного генетического скрининга (ПГС) в результативности программ вспомогательных репродуктивных технологий (ВРТ).
Материал и методы. В обзор включены данные зарубежных и отечественных статей, найденных в Pubmed по данной теме, опубликованных за последние10 лет.
Результаты. Описаны современные методы ПГС, показания к нему, клиническая эффективность программ ЭКО с ПГС.
Заключение. В настоящее время данные по эффективности ПГС противоречивы. Согласно данным Кохрановского систематического обзора, нет убедительных доказательств в пользу эффективности ПГС для увеличения уровня живорождения. Данные по применению ПГС у мужчин с нарушениями сперматогенеза также являются неопределенными. Однако ПГС все чаще применяется в клиниках ЭКО, опираясь на противоположные точки зрения о том, что каким бы способом ни проводился ПГС, его применение увеличивает частоту имплантации эмбрионов и снижает риск возникновения спонтанных абортов, тем самым повышая эффективность программ ВРТ, а также увеличивает вероятность рождения здорового ребенка.
Преимплантационная генетическая диагностика и скрининг (ПГД/ПГС) являются методами, применение которых в сфере вспомогательных репродуктивных технологий (ВРТ) неуклонно растет [1]. Конечной целью данных методов является определение генетической полноценности эмбриона, что в свою очередь снижает риски переноса эмбрионов с патологией и уменьшает шансы рождения детей с пороками развития.
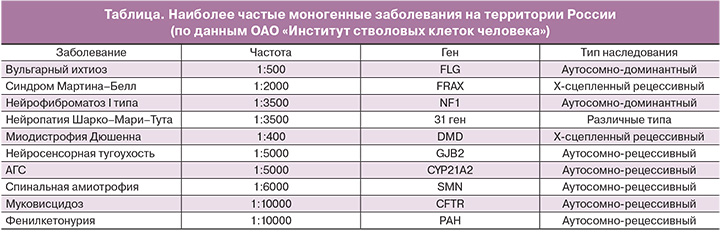
ПГД изначально была разработана для диагностики нарушений у потомства пар с моногенными заболеваниями, такими как муковисцидоз, или заболеваниями, сцепленными с полом, такими как мышечная дистрофия (таблица).
Вскоре эта методика стала применяться для диагностики различных видов анеуплоидии у эмбрионов, которые, как известно, повышают риск невынашивания беременности, мертворождений или рождения детей с хромосомными нарушениями.
Стремительному развитию ПГД в настоящее время способствует внедрение в эмбриологическую практику современных молекулярных методов анализа ДНК: сравнительной геномной гибридизации (CGH), секвенирования, полимеразной цепной реакции (ПЦР) с гибридизационно-флюоресцентной детекцией. Использование данных технологий расширяет возможности исследования генетического статуса эмбрионов человека, полученных in vitro. Независимо от того, какой метод молекулярного анализа используют для ПГД, исследование проводят на материале ДНК одной или нескольких эмбриональных клеток. Первые работы, в которых была продемонстрирована биопсия клеток у эмбрионов человека в целях генетической диагностики, выполнены на 3-и сутки раннего развития, когда эмбрион состоит из 6–8 клеток (стадия дробления). Биопсия бластомеров на восьмиклеточной стадии и сейчас является наиболее распространенной и широко практикуемой во многих лабораториях мира. Тем не менее, в настоящее время уже стали очевидными преимущества биопсии клеток трофэктодермы бластоцист (5-е сутки развития) по сравнению с биопсией бластомеров на стадиях дробления. В первую очередь, при биопсии клеток у бластоцист возможно получение большего объема клеточного материала для исследования, чем при биопсии на стадиях дробления, когда количество изъятого материала ограничено 1–2 клетками. Увеличение числа эмбриональных клеток, полученных в результате биопсии, упрощает проведение генетического анализа, повышает достоверность результата. Кроме того, на данной стадии эмбрионы обладают наиболее высоким потенциалом к имплантации. В ряде современных работ было показано, что частота выявленных анеуплоидий у бластоцист достоверно ниже, чем у дробящихся эмбрионов. Несмотря на очевидные преимущества биопсии трофэктодермы бластоцисты, этот подход имеет существенный недостаток: время для осуществления диагностики ограничено сроками проведения переноса эмбрионов и составляет интервал от нескольких часов до одних суток. Данное обстоятельство может являться причиной отмены переноса эмбрионов в текущем цикле ЭКО, криоконсервации бластоцист.
Хотя ПГД/ПГС являются действенным способом достижения беременности и уменьшения ее неблагоприятных исходов, важно не нанести значимого ущерба эмбриону во время проведения биопсии в целях сохранения его жизнеспособности и репродуктивных возможностей [2].
В рамках программы генетической диагностики наибольший удельный вес занимает ПГС анеуплоидий. Информация, полученная в результате исследования, является важным аргументом селекционного процесса, основанным не только на морфологических, но и на генетических характеристиках эмбриона [3, 4]. Генетический скрининг анеуплоидий позволяет определить хромосомный статус эмбрионов и выбрать эуплоидные эмбрионы на перенос, что дает возможность снизить уровень спонтанных абортов, уменьшить риск рождения детей с генетическими отклонениями, тем самым увеличить вероятность рождения здорового ребенка [4, 5]. Неудачи в предыдущих программах ЭКО/ИКСИ, замершие беременности, самопроизвольные выкидыши и аборты с выявленными хромосомными нарушениями в результате кариотипирования абортивного материала, а также наличие у плода генетических аномалий (синдром Дауна, Патау, Эдвардса и др.) – все это показания для проведения генетического тестирования эмбрионов.
Одним из наиболее важных показаний для проведения ПГД/ПГС является высокий генетический риск передачи наследственной патологии потомству. Такую диагностику проводят для носителей генных и хромосомных аномалий. Это могут быть моногенные болезни (аутосомно-рецессивные, аутосомно-доминантные, сцепленные с Х- или Y-хромосомой), а также хромосомные аномалии (числовые и структурные аберрации хромосом). Врачу-генетику, задачей которого является оценка риска рождения нездорового ребенка и помощь семье в предотвращении данной проблемы, важно помнить, что среди пациентов, нуждающихся в такой диагностике, могут быть пациенты с гонадным мозаицизмом. Генетический анализ образца крови пациента не покажет наличия у него мутации. Предположить же гонадный мозаицизм у пациента можно по данным анамнестического анализа его семьи – исследования имеющихся в семье больных дете...












