Акушерство и Гинекология №7 / 2019
Злокачественные новообразования и тромбозы
1) Научно-исследовательский институт тромбоза и атеросклероза, медицинский факультет Университета МакМастер, Онтарио, Канада;
2) ФГАОУ ВО «Первый Московский государственный медицинский институт им. И.М. Сеченова»
Минздрава России (Сеченовский Университет), кафедра акушерства и гинекологии № 2, Москва, Россия
Цель исследования. Провести систематический анализ данных о взаимосвязи рака и тромботических осложнений, проанализировать факторы риска развития тромбоза у онкологических пациентов.
Материалы и методы. В обзор включены данные зарубежных и отечественных статей по данной теме, найденных в e-Library и Pubmed и опубликованных за последние 10 лет.
Результаты. Представлены данные о возможностях применения антикоагулянтной терапии у онкологических больных. Проанализированы особенности ведения пациентов с рецидивирующими тромбозами: изменение дозировки низкомолекулярного гепарина или необходимость имплантации кава-фильтра в нижнюю полую вену.
Заключение. Активация коагуляции может увеличить риск развития рака, и, наоборот, действие антикоагулянтов может снизить риск развития некоторых видов рака.
Взаимосвязь между тромботическими осложнениями и злокачественными новообразованиями показана во многих работах. Ее часто называют феноменом Труссо, или синдромом Труссо, но этот термин первоначально характеризовал состояние воспаления вен, которое приводило к мигрирующему поверхностному тромбофлебиту на фоне скрытой формы рака внутренних органов [1]. Синдром был описан Арманом Труссо в 1865 г. [2, 3]. Это взаимное влияние между тромбозом глубоких вен и раком формирует порочный круг патогенеза как роста и метастазирования новообразования, так и тромбоэмболических осложнений (рис. 1).
Риск развития венозной тромбоэмболии (ВТЭ) увеличивается у пациентов с онкологическими заболеваниями. В классическом исследовании P. Prandoni и соавт. [4] у 842 пациентов с ВТЭ риск рецидива тромбоза в течение 12 месяцев составил 20,7% среди пациентов с онкологическими заболеваниями и 6,8% – у пациентов без злокачественных новообразований. В то же время рак диагностируется впервые у 20% пациентов с предшествующим эпизодом ВТЭ. Кроме того, возникновение ВТЭ является фактором негативного прогноза для пациентов со злокачественными новообразованиями, поскольку тромботические осложнения являются маркером снижения выживаемости [5]. С другой стороны, у 10% пациентов с идиопатическими ВТЭ диагностирован рак в течение следующих 12 месяцев [6]. Таким образом, взаимосвязь между злокачественными новообразованиями и тромботическими осложнениями определенно прослеживается.
Факторы риска тромботических осложнений, ассоциированных со злокачественными новообразованиями
Факторы риска развития тромбоза у пациентов со злокачественными новообразованиями могут быть разделены на опухоль-зависимые, терапия-зависимые и пациент-зависимые (табл. 1).

Факторы риска, связанные непосредственно с новообразованием, иллюстрируют три механизма, описанные Рудольфом Вирховым (триада Вирхова): снижение кровотока из-за компрессии опухолевыми массами вены крупного калибра; повреждение сосуда в процессе инвазии или воздействия на эндотелий опухолевых факторов и, наконец, гиперкоагуляция, обусловленная опухоль-ассоциированными прокоагулянтами и проагрегантами, в частности, муцином или раковым прокоагулянтом (СР), выделенным из аденокарциномы, который непосредственно способен активировать X-фактор свертывания.
Таким образом, существуют некоторые биомаркеры, которые можно использовать для оценки риска того, что у пациента с тромботическим эпизодом, вероятно, может быть рак: растворимый тканевый фактор (ТФ), растворимый P-селектин, повышенный C-реактивный белок, высокий Д-димер после острой фазы тромбоза, количество тромбоцитов выше 350×109/л или количество лейкоцитов выше 11×109/л.
Скрининг новообразований у пациентов с ВТЭ
У значительного числа пациентов с тромбозом рак может быть диагностирован в течение 12 месяцев [6, 7]. Этот вывод был получен из систематического обзора литературы по данным 36 исследований. Более того, обширный скрининг на наличие онкологических заболеваний с использованием компьютерной томографии органов брюшной полости и таза увеличивал скорость обнаружения данной патологии с 49 до 70%. Конечной целью скрининга является раннее выявление рака, чтобы увеличить шансы на излечение и тем самым снизить смертность. Опубликованы три проспективных рандомизированных исследования, в которых сравнивается возможность обнаружения злокачественного процесса при применении стандартного и расширенного скринингов у пациентов с идиопатической ВТЭ (табл. 2) [8–10].
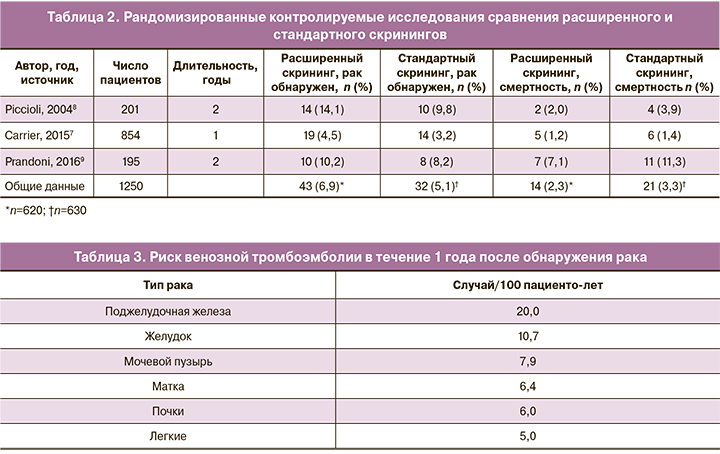
Увеличение частоты выявления случаев рака при проведении обширного скрининга статистически незначимое, однако смертность ниже в группе расширенного скрининга: относительный риск (ОР) составляет 0,67 (95% доверительный интервал (ДИ) 0,33–1,33). На основании чего мы не можем рекомендовать проводить расширенный скрининг на наличие онкологической патологии у каждого пациента с идиопатической ВТЭ, а только с учетом дополнительных факторов риска, связанных с полом и возрастом пациентов [8, 11].
Прогнозирование риска тромбоза у онкологических больных
Пациенты с онкологическими заболеваниями могут иметь повышенный риск кровотечения из-за тромбоцитопении, связанной с химиотерапией, или из-за локализации опухоли вблизи сосудов, что ограничивает возможности проведения рутинной тромбопрофилактики с помощью антикоагулянтов. При анализе 235 149 случаев рака H. Chew и соавт. [5] обнаружили, что в течение первого года после постановки диагноза наибольший риск тромбоэмболии наблюдался у пациентов с метастатическим раком поджелудочной железы (табл. 3).
Было разработано несколько моделей оценки риска развития ВТЭ для лучшего прогнозирования того, пациентам с какими онкологическими заболеваниями профилактика ВТЭ будет особенно полезна. Наиболее известной и достоверной является шкала Khorana по оценке риска ВТЭ, предназначенная для амбулаторных пациентов, получающ...












