Акушерство и Гинекология №8 / 2019
Значение фолатов для здоровья и развития ребенка
1) Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии
имени академика В.И. Кулакова Минздрава России, Москва, Россия;
2) Первый Московский государственный медицинский университет имени И.М. Сеченова (Сеченовский университет) Минздрава России, Москва, Россия
В приведенном обзоре литературы описан современный взгляд на метаболизм фолатов и фолиевой кислоты в организме человека и их роль для развития ребенка. Представлены методы исследования, применяемые для диагностики недостаточности и дефицита фолатов. Обсуждаются последствия дефицита фолатов и избытка фолиевой кислоты у беременных женщин и новорожденных детей. Проанализированы данные фолат-статуса недоношенных детей. На основании существующих работ показано, что на фоне применения современных схем вскармливания нет риска дефицита фолатов у недоношенных детей, а бесконтрольное дополнительное назначение фолиевой кислоты может приводить к ее избыточному поступлению и чрезмерным концентрациям в крови недоношенных детей.
Соединения фолиевой кислоты (фолаты, витамин В9) являются незаменимыми микронутриентами как для развития плода и ребенка, так и для жизнедеятельности организма в целом. Название «фолаты» происходит от латинского folium (лист) по первому месту их обнаружения – в листьях шпината. К настоящему времени известно более 150 соединений фолатов, которые относятся к водорастворимым витаминам и могут поступать в организм в виде фолилполиглютаматов, фолиевой кислоты и ее дериватов, включая 5-метилтетрагидрофолат (5-МТГФ) – метафолин) [1–3].
Метаболизм природных фолатов
Фолилполиглютаматы представляют собой основную природную форму витамина В9. Они содержатся во многих продуктах питания. Наиболее высок уровень фолатов в бобовых, зеленых овощах, зелени, печени животных, орехах, семенах подсолнечника. Цельнозерновые продукты являются лучшим источником фолатов, в сравнении с рафинированной мукой. Концентрация фолатов увеличивается в процессе прорастания зерен, а также при ферментации за счет синтеза фолатов дрожжами или молочнокислыми бактериями. С другой стороны, многие условия приводят к потере фолатов в продуктах (нагревание, измельчение, длительное хранение, воздействие света). Таким образом, обеспеченность организма природными фолатами будет зависеть от многих факторов, включающих диетические, географические и социально-экономические [1, 2, 4]. Фолаты синтезируются некоторыми бактериями кишечника; однако их всасывание в дистальных отделах тонкой кишки и в толстой кишке замедлено и не может компенсировать дефицит их поступления. [5]
Недостаток фолатов может развиваться при диете, обедненной фолатсодержащими продуктами, синдроме мальабсорбции (в т.ч. после резекции желудка для коррекции массы тела), алкоголизме, курении, сахарном диабете, гипотиреозе, а также при приеме ряда лекарственных средств (антиконвульсанты, сульфаниламиды, метотрексат, комбинированные гормональные контрацептивы). Наибольшему риску недостаточности фолатов подвержены определенные группы населения: беременные женщины и маленькие дети, особенно родившиеся недоношенными [2, 4, 6, 7].
В настоящее время критерием для определения фолат-дефицита является концентрация фолатов в сыворотке крови или в эритроцитах, ниже которой имеется риск развития мегалобластной анемии или гипергомоцистеинемии. Однако для снижения риска пороков развития нервной трубки у плода, чтобы обеспечивать быстро делящиеся клетки во время эмбрионального развития, требуются значительно более высокие концентрации фолатов в крови. В связи с этим был принят термин «недостаточность фолатов», определяющийся по уровню фолатов в эритроцитах у женщин репродуктивного возраста, ниже которого увеличивается риск развития пороков нервной трубки у плода [7-9]. В настоящее время четкое представление о распространенности фолат-дефицита и фолат-недостаточности среди населения и его групп отсутствует в связи с ограниченным числом данных, использованием различных методов определения фолатов в сыворотке и эритроцитах и различной их интерпретацией. Некоторое общее представление о фолатном статусе женщин репродуктивного возраста дано в обзоре Rogers L. et al. [7]. Дефицит фолатов определен у более 20% женщин в странах с низким уровнем доходов и у менее 5% – в странах с высоким уровнем доходов; в то же время недостаточность фолатов имела место более чем у 40% женщин в большинстве стран.
Биодоступность природных фолатов вариабельна; в смешанном питании она в среднем составляет около 50%, по одним данным [3], или 30–98% от биодоступности синтетической фолиевой кислоты – по другим [4]. Чтобы абсорбироваться, фолилполиглютаматы пищи гидролизуются в проксимальных отделах тонкой кишки до моноглутаматов, а затем в энтероцитах образуется 5-МТГФ – основная циркулирующая форма витамина В9 [1, 2, 5, 10]. Из кровяного русла внутрь клеток 5-МТГФ проникает с помощью фолат-транспортеров и деметилируется там в тетрагидрофолат (ТГФ) при участии В12-зависимого фермента метионинсинтазы; при этом метильная группа включается в цикл преобразования гомоцистеина в метионин. ТГФ становится звеном в биосинтезе предшественников ДНК (пуринов и пиримидинов), а также метаболизируется обратно в 5-МТГФ с помощью метилентетрагидрофолатредуктазы (МТГФР) (рисунок).
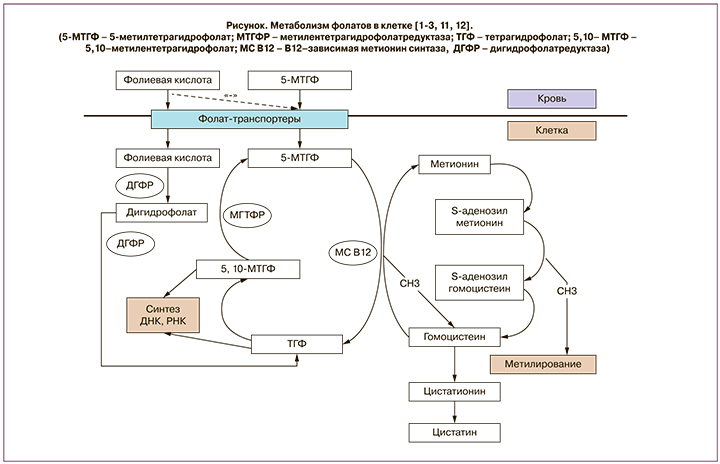
Фолаты имеют важнейшее значение для удаления избытка гомоцистеина. Дефицит фолатов ведет к повышению в плазме гомоцистеина, который обладает цитотоксическими свойствами. Снижение его концентрации в клетках обеспечивается двумя способами: с помощью фолат-зависимого реметилирования до метионина и путем транссульфирования с образованием цистатионина и затем – цистеина. Образовавшийся с участием фолатов метионин вновь через ряд превращений преобразуется в гомоцистеин, а освободившаяся метильная группа вступает в реакции метилирования ДНК, ядерных белков – гистонов и других компонентов обмена (рисунок)
Метаболизм фолиевой кислоты и метафолина
Фолиевая ...












